Physics For Scientists And Engineers 6E - part 174
S E C T I O N 2 2 . 8 • Entropy on a Microscopic Scale
693
Macrostate
Possible Microstates
Total Number of Microstates
All R
RRRR
1
1G, 3R
RRRG, RRGR, RGRR, GRRR
4
2G, 2R
RRGG, RGRG, GRRG, RGGR,
GRGR, GGRR
6
3G, 1R
GGGR, GGRG, GRGG, RGGG
4
All G
GGGG
1
Possible Results of Drawing Four Marbles from a Bag
Table 22.1
Example 22.11 Adiabatic Free Expansion—One Last Time
Let us verify that the macroscopic and microscopic ap-
proaches to the calculation of entropy lead to the same con-
clusion for the adiabatic free expansion of an ideal gas. Sup-
pose that an ideal gas expands to four times its initial
volume. As we have seen for this process, the initial and final
temperatures are the same.
(A)
Using a macroscopic approach, calculate the entropy
change for the gas.
(B)
Using statistical considerations, calculate the change in
entropy for the gas and show that it agrees with the answer
you obtained in part (A).
Solution
(A)
Using Equation 22.13, we have
(B)
The number of microstates available to a single mole-
cule in the initial volume V
i
is
. For N molecules,
w
i
!
V
i
/V
m
nR
ln
4
%
S ! nR
ln
"
V
f
V
i
#
!
nR
ln
"
4V
i
V
i
#
!
the number of available microstates is
The number of microstates for all N molecules in the final
volume V
f
!
4V
i
is
Thus, the ratio of the number of final microstates to initial
microstates is
Using Equation 22.18, we obtain
The answer is the same as that for part (A), which dealt with
macroscopic parameters.
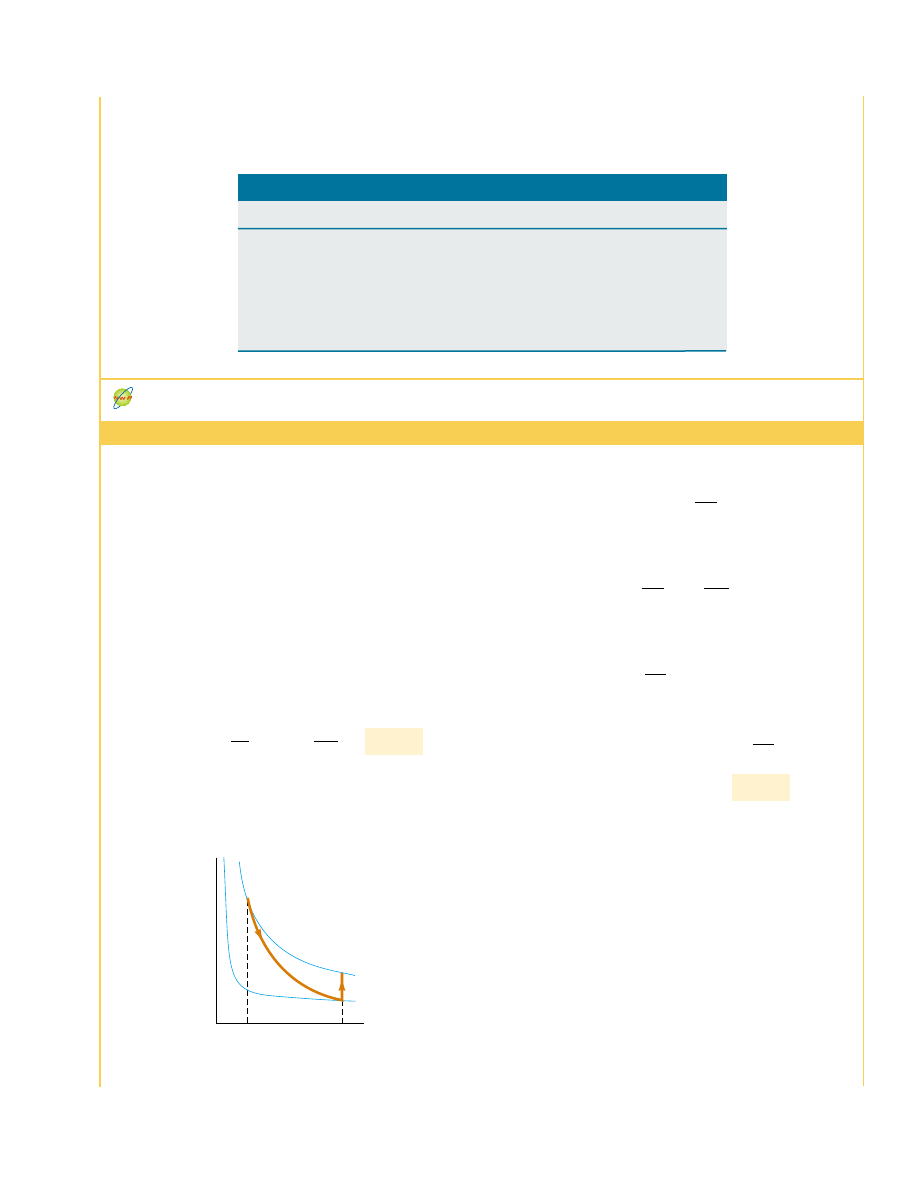
What If?
In part (A) we used Equation 22.13, which was
based on a reversible isothermal process connecting the
initial and final states. What if we were to choose a different
reversible process? Would we arrive at the same result?
Answer We must arrive at the same result because entropy is
a state variable. For example, consider the two-step process
in Figure 22.20—a reversible adiabatic expansion from
V
i
to 4V
i
, (A : B) during which the temperature drops from
T
1
to T
2
, and a reversible isovolumetric process (B : C) that
takes the gas back to the initial temperature T
1
.
During the reversible adiabatic process, %S ! 0 because
Q
r
!
0. During the reversible isovolumetric process (B : C),
we have from Equation 22.9,
nR
ln
4
! k
B
ln(4
N
) ! Nk
B
ln
4 !
%
S ! k
B
lnW
f
"
k
B
lnW
i
!
k
B
ln
"
W
f
W
i
#
W
f
W
i
!
4
N
W
f
!
"
V
f
V
m
#
N
!
"
4V
i
V
m
#
N
W
i
!
w
i
N
!
"
V
i
V
m
#
N
V
P
V
i
4V
i
B
C
A
T
1
T
2
Figure 22.20 (Example 22.11) A gas expands to four times its
initial volume and back to the initial temperature by means of a
two-step process.
Explore the generation of microstates and macrostates at the Interactive Worked Example link at http://www.pse6.com.
macrostate—two red marbles and two green marbles—corre-
sponds to the largest number of microstates. The least likely,
most ordered macrostates—four red marbles or four green
marbles—correspond to the smallest number of microstates.