содержание .. 1 2 3 ..
Аминирование поверхности магнитных наночастиц для иммобилизации кардиопротективных препаратов и флуоресцентных красителей - часть 2

заменяются на гидроксильные группы
(OH) с образованием
реакционноспособных силанольных групп, которые конденсируются с
другими силанольными группами для получения силоксальных групп (Si-O-
Si). Спирт (C2H5OH) и вода образуются в качестве побочных продуктов
конденсации.
На второй стадии полимер связывается с кристаллами магнетита (или
поверхностные кластеры), образуя ковалентную связь с OH-группами.
Дегидратация, а так же адсорбция полимеров силана к оксиду металла,
показывает формирование идеализированной магнитной наночастицы
модифицированного магнетита, то есть АПТЭС-магнетита
[7,
8], через
реакцию дегидратации. Конечный продукт, в результате реакции
силанизации в этой работе, был плотным, черным и демонстрировал сильное
намагничивание под магнитным полем.
Рисунок 1 - Упрощенная реакция гидролиза и конденсации полимерного силана
Рисунок 2 -Упрощенная реакция силанизации из АПТЭС на поверхности магнетита
Поверхность полученных магнитных наночастиц покрывали
3-
аминопропилэтоксисиланом (АПТЭС) путем силанизации, чтобы получить
модифицированные магнитные наночастицы. Процедура заключалась в
нагревании магнитной суспензии с глицерином и
40 мл
10% водного
раствора АПТЭСа (pH = 4, скорректированная с ледяной уксусной кислотой)
на водяной бане в течение 3 часов. После магнитной сепарации частицы
12
силанизированного магнетита тщательно промывают дистиллированной
водой и сушат, получая мелкий порошок.
В своей статье [9] авторы дважды перекристаллизовывали из воды β-
циклодикстрин (β-ЦД) и сушили в вакууме при 95 ºС в течение 24 часов
перед использованием. Дважды дистиллированную воду обескислородили
ульразвуковой обработкой ультразвуком, а затем барботировали азотом в
течение часа перед непосредственным использованием.
Для получения 1-толуолсульфонил-имидазола(ТС-Им) 13 г имидазола
растворяли в 50 мл CH2Cl2 и затем охлаждали до 0 ºС в колбе объемом 250
мл. Далее по каплям добавляют 16 г толуолсульфонил в 50 мл CH2Cl2. Затем
реакционную смесь восстанавливают до комнатной температуры и
перемешивают еще 2 часа. Полученную смесь фильтруют и промывают
этилацетатом-гексаном (1:1). Фильтрат концентрировали и в полученный
вязкий остаток выливали 10 мл этилацетата вместе с 100 мл гексана. Затем
белый твердый осадок собирали фильтрованием и хранили и хранили в
вакуумном эксикаторе в течение ночи с получением 16,94 г ( выход 90,8 %)
сухого ТС-Им.
Полученный ТС-Им (4,2 г) и β-ЦД (5,3 г) смешивали в колбе объемом
250 мл в присутствии воды объемом 120 мл в течение 2 часов. К смеси в
течение 20 минут добавляли раствор 2,4 г NaOH в 6,7 мл воды. Затем
реакцию продолжали еще 10 минут и непрореагировавшее твердое вещество
отфильтровывали через воронку из спеченного стекла. К фильтрату
добавляли
6,43 г NH4Cl и смесь концентрировали до половины ее
первоначального объема при непрерывном продувании воздуха в течение
ночи. Полученную суспензию отфильтровывали через воронку из спеченного
стекла, и собранный осадок был промыт водой, а впоследствии ацетоном.
Полученное твердое вещество 6-ТсО-β-ЦД высушивали до постоянной массы
в вакуумном эксикаторе с выходом 2,88 г (48%) [10].
Рисунок 3 представляет стратегию синтеза ЦД-МНЧ. Сначала были
подготовлены
6-ТсО-β-ЦД и АПТЭС-МНЧ. Следовательно, мы связали
13

фрагмент ЦД с фрагментом АПТЭС-МНЧ посредством реакции замещения в
положении С-6 6-ТсО-β-ЦД с помощью -NH2 в мягких условиях. До сих пор
молекулы ЦД транспортировались на поверхности МНЧ. Процессы
контролировались при помощи ядерного магнитного резонанса (ЯМР), ИК-
Фурье спектроскопии (FTIR) и термогравиметрического анализа (TGA).
Рисунок 3 - Этапы подготовки для изготовления циклодикстрин-функционализированных
оболочек Fe3O4/SiO2 нанокомпозита
Они сообщили, что МНЧ с различными диаметрами 6 и 12 нм были
синтезированы методом контролируемого соосаждения из водного раствора
Fe2+ и Fe3+ в инертной атмосфере. Их готовят при комнатной температуре 80
14

ºС, соответственно. Это значение падает в диапазоне размеров
суперпарамагнитных наночастиц Fe3O4 около 20 нм [11,12,13].
На рисунках 4, а−с представлены изображения TEM АПТЭС-МНЧ и
рисунках
4, d−f ЦД-МНЧ. Наблюдались хорошо сформированные
сферические или эллипсоидные частицы. Диаметр сердцевина как для
покрытых АПТЭС, так и для ЦД-функционализированных наночастиц
составляет около 13 нм. На рисунках 4.a и 4.b можно наблюдать однородные
наночастицы, однако, агломератные кластеры существуют из-за отсутствия
поверхностно-активных веществ.
Рисунок 4 - ПЭМ-изображения АПТЭС-МНЧ (a−c) и ЦД-МНЧ (d−f)
В поле зрения ТЕМ нет видимой внешней оболочки. Объясняется это
тем, что силанизация АПТЭС приводит к образованию амонослоя сетчатой
структуры Si-O, а оболочка слишком тонка, чтобы ее можно было
распознать. Эта архитектура очень хорошо иллюстрируется на схеме 1. При
дальнейшем увеличении коэффициента, решетка Fe3O4 может отчетливо
наблюдаться в изображении HRTEM на рис. 2, с. Как видно из рисунка 2, d−f,
можно отчетливо различить структуру «ядро-оболочка», и серый аморфный
слой, указанный стрелками, хорошо виден вне темных ядер магнетита. Это
связано с тем, что размер β-ЦД составляет около 1 нм [14], что сопоставимо с
размерами ядра МНЧ. Изображения можно рассматривать как прямое
доказательство того, ЦД-функционализированный МНЧ был успешно
15
синтезирован. Как видно на вставках рис. 2, c и 2, f SAED выполняли как на
АПТЭС-МНЧ, так и на ЦД-МНЧ, соответственно. Обе модели SAED
показывают, что ядра двух образцов являются нанокристаллами, и вся
информация хорошо согласуется с результатами XRD.
Для дальнейшего подтверждения трансплантата ЦД были получены
спектры FTIR МНЧ, АПТЭС-МНЧ и ЦД-МНЧ, как показано на рис. 5. Для
МНЧ две сильные полосы поглощения около 633 и 562 см-1 являются
результатами расщепления полосы при 570 см-1, что соответствует связи Fe-
O в объеме магнетита. Полоса 477 см-1 происходит из-за смещения полосы 2
связи Fe-O булкмагнетита на длине 375 см-1. Указанные три характерные
полосы можно наблюдать с небольшим сдвигом после модификаций АПТЭС
и ЦД. По сравнению с АПТЭС, АПТЭС-МНЧ представляет полосы
поглощения при 2924 и 2854 см-1, отнесенные к валентному колебанию связи
С-Н пропиламиновой группы. Силикатная сеть прилипает к поверхности
частицы через связь Fe-O-Si. Соответствующая полоса адсорбции появилась
около 584 см-1 и перекрывала колебания Fe-O МНЧ. Однако силановый
полимер на поверхности АПТЭС-МНЧ может быть подтвержден полосами
около 1030 и 1110 см-1 от групп Si-O-H и Si-O-Si. Две широкие полосы на
частотах 1626 и 3403 см-1 относятся к валентным колебаниям N-H и режиму
изгиба свободной
-NH2-группы, соответственно. Для образца ЦД-МНЧ
широкая полоса в диапазоне 1200-900 см-1 является характерным пиком
поглощения β-ЦД. В спектре так же наблюдаются деформационные
колебания δ(С-Н) и δ(О-Н) групп -СН2 и -ОН между 1460 и 1310 см-1 [15, 16,
17].
16

Рисунок 5 - ИК-Фурье спектры МНЧ (a), АПТЭС-МНЧ (b) и ЦД-МНЧ (c)
TGA был применен для оценки органического содержимого на
поверхности синтезированных образцов. На рисунке 6, кривая TGA для МНЧ
представляет первую потерю веса ниже
138
ºС, что можно объяснить
испарением адсорбированного испарителя(воды и этанола), прикрепленного
к поверхности частиц. После небольшой потери веса, неожиданное
увеличение веса происходит в диапазоне температур от 138 до 208 ºС. Тот же
результат был получен после обработки другого параллельного образца МНЧ
в тех же условиях. Согласно [18] этот прирост массы можно объяснить
окислением Fe3O4 до Fe2O3. Результат и данные XRD подтверждают, что
сформировалась доминирующая фаза Fe3O4. По оценкам, общая потеря веса в
температурном диапазоне составляет 3,3% из-за потери адсорбированной
воды, а так же обезвоживания поверхностных групп -OH. Кривая TGA
АПТЭС-МНЧ демонстрирует два шага потери веса. Резкое падение веса 3%
можно наблюдать в диапазоне температур (190−410) ºС, и оно является
следствием термического разложения 3-аминопропильных групп. Кривая для
17

ЦД-МНЧ представляет два различных этапа в диапазоне измерения от 30 до
425 ºС. Ниже 200 ºС скорость потери массы относительно невелика из-за
потери остаточной воды, прилипающей к поверхности образца и
адсорбированной в полостях ЦД.
Рисунок 6 − Кривые ТГА для МНЧ, АПТЭС-МНЧ и ЦД-МНЧ
Тогда есть определенная массовая потеря веса в 4,1% между 250 и
425 ºС. Ответственность за произошедшее несет разбивка ЦД-частей и
других органических структур. До сих пор кривые TGA так же передавали
очевидную информацию о том, что ЦД молекулы органической структуры
успешно привиты. По этим данным количество ЦД, закрепленной на
поверхности МНЧ, оценивается как 10 мг·г-1.
Магнитные характеристики, характерные для суперпарамагнитного
поведения, могут быть четко обнаружены как для МНЧ, так и для ЦД-МНЧ.
Суперпарамагнетизм подразумевает повторное диспергирование магнитных
наночастиц в растворе без возникновения сильной агрегации, от которой
обычно страдают ферромагнитные наночастицы. Намагниченность
насыщения ЦД-МНЧ составляет 69 A·м2·кг-1. Значения относительно ниже,
18
чем для МНЧ из-за двух слоев покрытия АПТЭС и ЦД. Эта особенность
позволяет использовать наночастицы для высокоэффективной магнитной
манипуляции при использовании в качестве носителей лекарственных
средств при относительно низком внешнем магнитном поле.
1.4 Использование в медицине магнитных наночастиц
Несмотря на достижения медицины в области фармакологии, многие
лекарственные препараты обладают одним весьма серьезным недостатком, а
именно, негативным воздействием на интактные ткани. Иммобилизация
лекарств на наноносителях позволяет повысить их биодоступность,
увеличивая растворимость и позволяя преодоление различного рода
барьеров, такого как гематоэнцефалического барьера, снизить давление на
организм в целом, воздействуя целенаправленно на поврежденную область.
Дополнительным преимуществом является возможность создания
препаратов, обладающих пролонгированным действием. Таким образом,
иммобилизованные на наноносители препараты открывают новые горизонты
и дают перспективы для эффективного лечения различных очаговых
патологических процессов, например раковых опухолей, патологии сердца и
т.д.
Существует два метода адресной доставки
(рис.
7) препаратов к
поврежденным тканям: пассивная и активная [19].
19
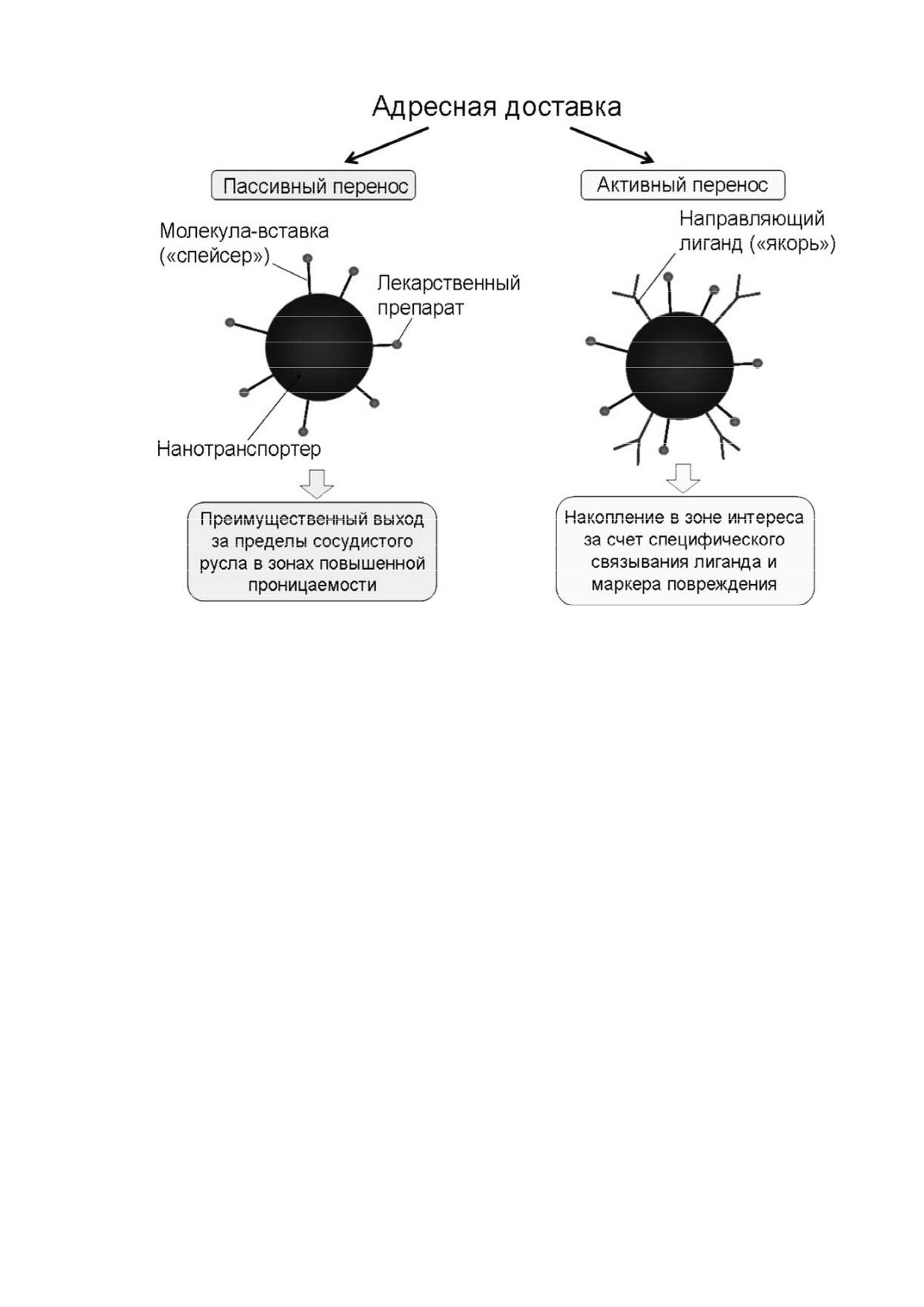
Рисунок 7 - Схема адресной доставки препаратов
Пассивная доставка осуществляется за счет высокой проницаемости
капилляров в очаге повреждения
[20]. Активная адресная доставка
выполняется методом прикрепления носителя не только действующего
вещества, но и управляющих лигандов, специфически связывающихся с
маркерами повреждения на мембране измененных клеток [21].
Для доставки препаратов в качестве носителей в последнее время
рассматриваются фуллерены, липосомы, хитозан и др. рис. 8 [22].
20

Рисунок 8 - Перспективные носители лекарственных препаратов: а - хитозан; б -
магнетит; в - нанотрубки; г - фуллерены; д - липосомы; е - дендримеры; ж - пористый
кремний
1.5 Анализ химического состава наночастиц и модифицированной
поверхности
В статье
[20] показывают результаты рентгено-дифракционного
анализа осажденных и силанизированных порошков. Образцы оксидов
железа и оксигидроксидных продуктов были включены для сравнения. Оба
магнетита и маггемита имеют состав шпинели, их линии близки и трудно
отличаются друг от друга при рентгеновском излучении. Отсутствие линий
110 и 104 указывает, что гетита и гематита не образуется. Пиков Fe(OH)3, а
так же других фаз гидроксидов железа γ-FeO(OH) и δ-FeO(OH) не было
обнаружено. Как показано на рисунке 9, магнетит составлял доминирующую
фазу в осажденном и силанизированном порошках, хотя некоторое
количество маггемита, вероятно, могло образоваться в качестве примеси в
процессе соосаждения и силанизации.
21

Рисунок 9 - Спектры силанизированных порошков
Магемит коричневый отличается от черного магнетита, но при наличии
следов в образце магнетита его не возможно отличить. Размер кристаллитов
оценивали по рентгенограмме порошковой дифракции по измерению
ширины полувысоты самой сильной плоскости отражения с использованием
известной формулы Шеррера. Оба магнетита и APTES-магнетит
-
наночастицы, имеют размеры равные 12 нм: когда частицы подвергаются
термической обработке, кристаллит может расти в размере и изменять его
физические свойства. Такой же размер был обнаружен для магнетита и
кристаллитов APTES-магнетита, что указывает на то, что нагревание на
22

водяной бане в течение
3 часов в течение реакции силанизации было
недостаточным, чтобы вызвать рост и, следовательно, повлиять на
физические свойства частиц магнетита.
Для подтверждения покрытия поверхности магнетита через реакцию
силанизации был получен спектр ИК-Фурье АПТЭС-магнетита (см. рис. 10).
Присутствие магнетитовых полос можно наблюдать при помощи двух
сильных полос поглощения около 632 и 585 см-1: эти полосы возникают в
результате расщепления полосы 570 см-1. Что соответствует связи Fe-O в
объемном магнетите. Кроме того, наблюдалась полоса поглощения около
440 см-1, что соответствует сдвигу полосы связи Fe-O объемного магнетита (
при 375 см-1) до более высокого волнового числа.
Рисунок 10 − ИК-Фурье спектр АПТЭС-наночастицы магнетита
Цепь кремнезема адсорбируется на поверхности магнетита с помощью
связей Fe-O-Si. Эта полоса адсорбции не может быть замечена в спектре ИК-
Фурь, так как появляется около 584 см-1 и, следовательно, перекрывается с
колебанием Fe-O магнетитовых наночастиц. Таким образом, адсорбция
силанового полимера на поверхности частиц магнетита была подтверждена
полосами при 1113, 1048 и 989 см-1, отнесенными к группам Si-O-H и Si-O-Si.
23
содержание .. 1 2 3 ..