Химия. Задания открытой формы с кратким ответом (2020 год)
Задания открытой формы с кратким ответом
Задание. Дайте правильный ответ.
1. Укажите, какое из перечисленных явлений: скисание молока, горение природного
газа, плавление металла, ржавление железа, относится к физическим.
2. Из предложенного перечня явлений: образование инея, таяние льда, ржавление
железной проволоки, плавление олова выпишите только химическую реакцию.
3. Среди предложенных веществ H2S, S8, SО2, H2SО4 определите простое вещество.
4. Какой из элементов проявляет постоянную валентность: P, Na, Cr, Fe?
5. Укажите, какой из элементов проявляет постоянную валентность: S, K, Cr, Fe.
6. Укажите валентность серы в SO3.
7. Какой из химических элементов проявляет в соединениях валентность III: Ba, Al,
Ca, S?
8. Какой из химических элементов проявляет в соединениях валентность III: Ba, Al,
C, S?
9. Составьте формулу оксида серы, учитывая, что сера в нем проявляет
максимальную валентность.
10. Определите, в каком из соединений: N2H4, NH3, NH4Cl, N2O5, азот проявляет
валентность ΙV и степень окисления -3.
11. Определите, в каком из соединений: NF3, NH3, N2O3, AlCl3, степени окисления
химических элементов равны -3 и +1.
12. Определите, в каком из соединений: N2H4, NH3, NH4Cl, HNO3, химический
элемент азот проявляет степень окисления +5.
13. В каком из соединений: N2O5; NH3; HNO3; NO, химический элемент азот
проявляет наименьшую степень окисления?
14. В каком из соединений: NO2, HNO3, NO, NH3 химический элемент азот проявляет
наименьшую степень окисления?
15. В каком из соединений с серой: Na2S, MgS, Fe2S3, Al2S3, металлический элемент
проявляет наименьшую степень окисления?
16. В каком из соединений с серой: K2S, CaS, Fe2S3, Al2S3, металлический элемент
проявляет наименьшую степень окисления?
17. Из предложенных веществ: FeO, PbO2, Cr2O3, Na2O, укажите соединение, в
котором степень окисления металлического элемента равна +1.
18. Укажите степень окисления азота в соединениях, которые образуются при
взаимодействии азота с активными металлами.
19. Укажите формулу вещества из предложенных: S, H2SO3, K2S, SO3, в котором сера
проявляет минимальную степень окисления.
20. Укажите формулу вещества из предложенных: S, H2SO4, H2S, SO2, в которой сера
проявляет минимальную степень окисления.
21. Какой из указанных химических элементов: Al, P, F, K, проявляет наибольшую
степень окисления в соединениях с кислородом?
22. Какую степень окисления проявляет сера в соединении с водородом?
23. Определите степень окисления серы в соединении Na2SO4.
24. Напишите формулу бинарного соединения, образованного элементом
А (VIIА группа) в низшей степени окисления и элементом В (II группа).
25. Напишите формулу бинарного соединения, образованного элементом
А (VI группа) в низшей степени окисления и элементом В (III группа).
26. Напишите формулу бинарного соединения, образованного элементом
А (IV группа) в низшей степени окисления и элементом В (III группа).
27. Напишите общую формулу оксидов элементов VIА группы периодической
системы Д.И. Менделеева.
28. Напишите общую формулу оксидов элементов V группы периодической системы
Д.И. Менделеева.
29. Укажите в ряду: F, Cl, Mn, Br один химический элемент, который отличается от
остальных по положению в периодической системе химических элементов Д.И. Менделеева.
30. Укажите, какой из элементов: фтор, сера, хлор, иод, не образует соединения в
высшей степени окисления, равной номеру группы.
31. Укажите номера периодов периодической системы, в которых находятся
f-элементы.
32. В каких группах периодической системы содержится только по одному элементу-
неметаллу?
33. Среди предложенных: Be, B, Li, F, укажите химический элемент, у которого
наибольший атомный радиус.
34. Укажите орбитали, на которых размещаются электроны в атоме кислорода.
35. Укажите наиболее электроотрицательный химический элемент среди элементов
VI А группы периодической системы.
36. Укажите среди предложенных химических элементов: Ne, F, Li, N, наиболее
активный неметаллический элемент второго периода периодической системы.
37. Из предложенных химических элементов Al, S, Cl, P, выберите элемент, который
проявляет наиболее ярко выраженные неметаллические свойства.
38. Укажите, у какого из химических элементов: Li, Al, Са, Na, наиболее выражены
металлические свойства.
39. Напишите, у какого из химических элементов: Li, Fe, Mg, Na, наиболее выражены
металлические свойства?
40. Напишите в ответе от атома какого элемента - лития или калия - легче оторвать
электрон внешнего слоя?
41. Напишите чему равно число принятых электронов согласно схеме:
N+5 + nē N−3
42. Укажите, у какого из предложенных химических элементов: Rb, Sr, Cs, K,
наиболее выражены металлические свойства.
43. Какой из предложенных химических элементов: Si, P, S, Cl, обладает наибольшей
окислительной активностью?
44. Какой из предложенных химических элементов: Si, P, S, Cl, обладает наибольшей
восстановительной активностью?
45. Выберите из предложенных схем Са0 Са2+; Са2+ Са0, схему превращения, в
которой металл проявляет восстановительные свойства.
46. Определите число энергетических уровней и число электронов на внешнем
энергетическом уровне атома магния.
47. Определите число энергетических уровней и число электронов на внешнем
энергетическом уровне атома кальция.
48. Укажите для атома хлора заряд ядра и число электронов на внешнем
энергетическом уровне.
49. Определите у атома фосфора заряд ядра и число электронов на внешнем
энергетическом уровне.
50. Укажите максимальное количество электронов на d-подуровне.
51. Из предложенных химических элементов: алюминий, хлор, фосфор, бор,
определите атом, который в невозбужденном состоянии содержит три неспаренных
электрона.
52. В атоме химического элемента всего 6 s-электронов и 9 p-электронов. Сколько
электронов на его внешнем энергетическом уровне?
53. В атоме химического элемента всего 6 s-электронов и 11 p-электронов. Сколько
электронов на его внешнем энергетическом уровне?
54. Определите химический элемент по электронной конфигурации его атома
1s22s22p63s23p4.
55. Определите химический элемент по электронной конфигурации 1s22s22p63s23p5.
56. Определите, атом какого химического элемента имеет электронную формулу
1s22s22p63s23p2.
57. Определите, у атома, какого элемента электронная формула 1s22s22p63s23p1.
58. Укажите, какое из предложенных водородных соединений: СН4, SiH4, H2S, H2O,
может образовать элемент, электронная конфигурация атома которого 1s22s22p63s23p4.
59. Укажите электронную формулу внешнего энергетического уровня атома фосфора.
60. Укажите электронную формулу внешнего энергетического уровня атома
углерода.
61. Укажите, какой из атомов: углерод, фосфор, кальций или кислород, имеет
сходную электронную конфигурацию внешнего энергетического уровня с атомом азота.
62. Определите, электронная конфигурация какой из предложенных частиц: Са2+, K0,
Сl+, N3−, соответствует электронной конфигурации атома аргона.
63. Определите, электронная конфигурация какой из предложенных частиц: Са0, K+,
Сl+, Zn2+, соответствует электронной конфигурации атома аргона.
64. Какая из частиц: F0, Li+, О0, Na+ имеет такую же электронную конфигурацию, что
и атом неона?
65. Укажите электронную конфигурацию внешнего энергетического уровня атомов
щелочных металлов.
66. Определите число нейтронов в атоме изотопа 37Cl.
67. Определите число нейтронов в атоме изотопа 26Mg.
68. Определите число нейтронов в ядре атома нуклида ванадия 51V.
69. Чему равна сумма нейтронов и протонов в атоме 65Zn?
70. В каком из предложенных нуклидов: 56Fe, 126I, 58Co, 12C, содержится одинаковое
число протонов и нейтронов?
71. Состав драгоценного камня изумруда описывает формула BexAl2(SiO3)6. Исходя
из электронейтральности вещества, определите и укажите индекс x в этой формуле.
72. Укажите, какой из металлов: Pb, Mg, K или Fe реагирует с водой при 20°С с
наибольшей скоростью.
73. Какое водородное соединение: CH4, NH3, H2O, HCl окрашивает водный раствор
лакмуса в синий цвет?
74. Напишите в ответе ион, который содержится в растворе, если известно, что в этом
растворе цвет универсальной индикаторной бумаги изменяется на красный.
75. Напишите общую формулу водородного соединения, которые образуются при
взаимодействии элементов VIIA группы периодической системы с водородом.
76. Напишите общую формулу водородных соединений, которые образуются при
взаимодействии химических элементов VIA группы периодической системы с водородом.
77. Напишите общую формулу водородных соединений, которые образуются при
взаимодействии химических элементов VA группы периодической системы с водородом.
78. Напишите формулу высшего оксида химического элемента, который образует
летучее водородное соединение состава Н2Э.
79. Напишите формулу высшего оксида химического элемента, который образует
летучее водородное соединение состава НЭ.
80. Напишите высший оксид элемента с протонным числом 17.
81. Напишите высший оксид элемента с протонным числом 6.
82. Укажите сумму протонных чисел атомов натрия и кальция.
83. Укажите сумму протонных чисел атомов магния и кальция.
84. Укажите сумму индексов в формуле высшего оксида химического элемента,
протонное число которого 34.
85. Укажите протонное число химического элемента, который расположен в 4-м
периоде, III-А подгруппе.
86. Напишите формулу оксида, если его образует элемент с порядковым номером 11.
87. Среди предложенных формул: Na2O, Al2O3, CO2, CO, укажите основный оксид.
88. Среди предложенных формул: Na2O, Al2O3, CO2, H2CO3, укажите основный оксид.
89. Среди предложенных формул: Cl2O7, P2O5, N2O, SO3 укажите несолеобразующий
оксид.
90. Среди предложенных формул: SO2, P2O5, CO, SO3.укажите несолеобразующий
оксид.
91. Укажите, какой из оксидов: SiO2, NO2, Аl2O3, SO2, относится к амфотерным.
92. Какой из оксидов: SiO2, NO2, ZnO, SO2, относится к амфотерным?
93. Какой из оксидов: K2O, SO3, Al2O3, MgO, может реагировать и с кислотами и со
щелочами?
94. Определите в предложенном перечне веществ: Na2O, CO, NO2, ZnO, оксид,
который при взаимодействии с водой образует щелочь.
95. Какой из оксидов: SiO2, CO, Nа2O, SО2 при взаимодействии с водой образует
кислоту?
96. Укажите, какой из оксидов: Mn2O7, Mn2O3, MnO, MnO2, обладает наиболее
выраженными основными свойствами.
97. Какой из оксидов: Сu2O, SO3, Al2O3, MgO, обладает ярко выраженными
кислотными свойствами?
98. Среди предложенных формул: CuOH, Fe(OH)2, Fe(OH)3, KOH, укажите щелочь.
99. Среди предложенных формул: Al(OH)3, KOH, Cu(OH)2, Fe(OH)2, укажите
щелочь.
100. Среди предложенных формул: NaOH, Zn(OH)2, Ca(OH)2, KOH, укажите
амфотерный гидроксид.
101. Среди предложенных формул: NaOH, Al(OH)3, Ca(OH)2, KOH, укажите
амфотерное основание.
102. Напишите формулу кислоты, образованной элементом, которому соответствует
высший оксид состава Э2О5.
103. Среди предложенных формул кислот: H3PO4, HClO4, H2СO3, HCl укажите
двухосновную кислоту.
104. Среди предложенных формул: HF, HCl, H2SO4, HNO3, укажите
кислородсодержащую двухосновную кислоту.
105. Среди предложенных веществ: H2SiO3, H2S, HBr, H3BO3 укажите трехосновную
кислоту.
106. Среди предложенных формул: H2S, H2SO3, H2SO4, HNO3, определите
одноосновную кислоту.
107. Среди предложенных формул кислот: HCl, H2SO3, H2SO4, HNO3, укажите
одноосновную кислородсодержащую кислоту.
108. Среди предложенных формул: H2CO3, H3PO4, HNO3, H2SiO3, укажите
кислородсодержащую одноосновную кислоту.
109. Среди предложенных формул: HPO3, HBr, H2SO3, H2CO3, укажите
бескислородную кислоту.
110. Среди предложенных формул: H2SO4, H2S, HBr, HPO3 определите двухосновную
бескислородную кислоту.
111. Среди предложенных веществ: H2SO4, H2SO3, H2S, H2SiO3, укажите
нерастворимую кислоту.
112. Среди предложенных веществ: H2SO4, H2SO3, Н3РО4, H2SiO3 укажите
нерастворимую в воде кислоту.
113. Среди предложенных формул: HNO3, H2SO4, HCl, HI, укажите кислоту, которая
может образовывать кислые соли.
114. Среди предложенных формул солей: (СuOH)2CO3, Na2CO3, NaHCO3, (NH4)2CO3,
укажите формулу кислой соли.
115. Среди предложенных формул: NaNO3, CuSO4, KРO3, NaHСO3, укажите кислую
соль.
116. Среди предложенных формул: NaNO3, CuSO4, K3PO4, NaHSO4, определите
кислую соль.
117. Среди предложенных формул: K2CO3, BaSO4, AgNO3, MgCl2, укажите
нерастворимую соль.
118. Среди предложенных формул: NaCl, AgNO3, BaSO4, Mg(NO3)2, определите
нерастворимую соль.
119. Среди предложенных формул: Mg(OH)Cl, Na2HPO4, Al2(SO4)3, KH2PO4, укажите
среднюю соль.
120. Среди предложенных формул: AlCl3, Mg(OH)Cl, Na2HPO4, KH2PO4, выберите
среднюю соль.
121. Среди предложенных формул: Fe2(SO4)3, Mg(NO3)2, Mg(OH)Cl, NaHCO3,
укажите основную соль.
122. Среди предложенных формул: Cu(OH)Cl, Fe2(SO4)3, Cu(NO3)2, Na2CO3, укажите
основную соль.
123. Укажите заряды катионов и анионов, образующихся в водном растворе
карбоната калия.
124. Укажите заряды катионов и анионов, образующихся в водном растворе хлорида
калия.
125. Укажите заряды катионов и анионов, существующие в растворе хлорида калия.
126. Вычислите и укажите в ответе заряд карбонат-иона в формуле гидрокарбоната
калия.
127. Вычислите и укажите в ответе заряд сульфат-иона в формуле гидросульфата
натрия.
128. Напишите уравнение диссоциации нитрата магния в водном растворе.
129. Укажите вещества, которые обуславливают временную жесткость воды.
130. Укажите вид химической связи, образованной атомами с небольшой разницей в
электроотрицательности.
131. Укажите тип связи, которая образуется между атомами с большой разницей в
электроотрицательности.
132. Укажите тип химической связи между атомами серы и кислорода.
133. Укажите вид химической связи между атомами серы и водорода.
134. Определите среди веществ: CO, NF3, H2S, KCl, соединение с ионной связью.
135. Определите среди веществ: CO2, NF3, H2S, NaCl, соединение с ионной связью.
136. Определите, в каком из соединений: NO2, N2, P4, CaBr2, существует ионная
связь.
137. Какая из предложенных молекул: Н2, N2, F2, О2 имеет наиболее прочную
химическую связь в молекуле?
138. Среди предложенных: HCl, CH4, N2, F2, выберите формулу вещества с
наибольшим количеством ковалентных связей.
139. Чему равно число ковалентных связей, которое может образовать
невозбужденный атом серы за счет неспаренных электронов?
140. Укажите тип орбиталей атомов водорода и хлора соответственно, которые
перекрываются в процессе образования молекулы HCl.
141. Укажите тип орбиталей атомов хлора, которые перекрываются в процессе
образования молекулы Cl2.
142. Укажите тип орбиталей атомов фтора, которые перекрываются в процессе
образования молекулы F2.
143. Определите число общих электронных пар между атомами азота в молекуле N2.
144. Определите число общих электронных пар между атомами фтора в молекуле F2.
145. Определите число общих электронных пар между атомами хлора в молекуле Cl2.
146. Укажите, в каком из соединений: BaO, HBr, K2O, NaCl, химическая связь между
атомами образована за счет общей электронной пары.
147. Укажите, в каком из соединений: HCl, BaO, Na2O, FeCl3, химическая связь
между атомами образована за счет общей электронной пары.
148. Из предложенных: H2S, Cl2, CH4, HCl, укажите вещество, в котором химическая
связь наиболее полярная.
149. Из предложенных: H2S, Cl2, Na2O, HCl, укажите вещество, в котором химическая
связь наименее полярная.
150. Из предложенных HCl, HF, HI, HBr, укажите вещество, в котором химическая
связь наиболее полярная.
151. Из предложенных HCl, HF, HI, HBr, укажите вещество, в котором химическая
связь наименее полярная.
152. Среди предложенных веществ: CaO, NaCl, N2, CO2, укажите вещество с
ковалентной неполярной связью.
153. Среди веществ: CaO, NaCl, N2, H2S укажите вещество с ковалентной полярной
связью.
154. Среди предложенных веществ: этан, фторид натрия, оксид углерода (II), этанол,
укажите вещество, между молекулами которого существует водородная связь.
155. Какую химическую связь образует в соединении с водородом химический
элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2?
156. Укажите тип кристаллической решетки в бинарном соединении химических
элементов с протонными числами 9 и 19.
157. Укажите тип кристаллической решетки для веществ, которые являются одними
из самых твердых.
158. Из предложенных веществ: лед, алмаз, иод, поваренная соль, укажите вещество,
которое в твердом состоянии имеет атомную кристаллическую решетку.
159. Укажите, какое из соединений: хлорид цинка, оксид железа (ΙΙΙ), оксид серы (ΙV),
бромид калия, является веществом молекулярного строения.
160. Укажите в какой из молекул: аммиак, ацетилен, этилен, хлороводород, есть две
-связи.
161. Укажите число σ-связей в молекуле этана.
162. Укажите тип гибридизации атомов углерода в молекулах насыщенных
углеводородов.
163. Укажите тип гибридизации атомов углерода в молекулах алканов.
164. Укажите угол связи между атомами углерода в молекулах насыщенных
углеводородов.
165. Укажите число химических элементов и число атомов в составе соединения,
формула которого CH3COOH.
166. Напишите название фракции, которая выделяется при перегонке нефти и
содержит углеводороды от С5Н12 до С11Н24.
167. Укажите значение, которое соответствует углу между гибридными
электронными орбиталями атомов углерода в молекуле этена.
168. Укажите из предложенного перечня: спирты, углеводы, жиры, углеводороды,
главную составляющую нефти.
169. Укажите пространственное строение молекулы, которое характерно для первого
члена гомологического ряда предельных углеводородов.
170. Укажите пространственное строение молекулы, которое соответствует
sp-гибридизации атомных орбиталей.
171. Укажите количество ковалентных связей между атомами углерода в молекуле
бутана.
172. Укажите мономер, который полимеризуется с образованием соединения,
формула которого [−CH2−CH(CH3)−]n.
173. Укажите мономер, который полимеризуется с образованием соединения,
формула которого (−CH2−CH2−)n.
174. Напишите молекулярную формулу алкана, молекула которого содержит шесть
атомов углерода.
175. Напишите молекулярную формулу алкена, молекула которого содержит пять
атомов углерода.
176. Напишите молекулярную формулу алкена, молекула которого содержит шесть
атомов углерода.
177. Напишите молекулярную формулу алкина, молекула которого содержит шесть
атомов углерода.
178. Напишите молекулярную формулу диметиламина.
179. Напишите молекулярную формулу одноосновной карбоновой кислоты,
молекула которой содержит два атома углерода.
180. Напишите молекулярную формулу пальмитиновой кислоты.
181. Напишите молекулярную формулу стеариновой кислоты.
182. Составьте молекулярную формулу алкадиена, содержащего пять атомов
углерода.
183. Составьте молекулярную формулу алкадиена, содержащего четыре атома
углерода.
184. Составьте структурную формулу 2-метилбутаналя.
185. Составьте структурную формулу 3,4-диметилгексена-1.
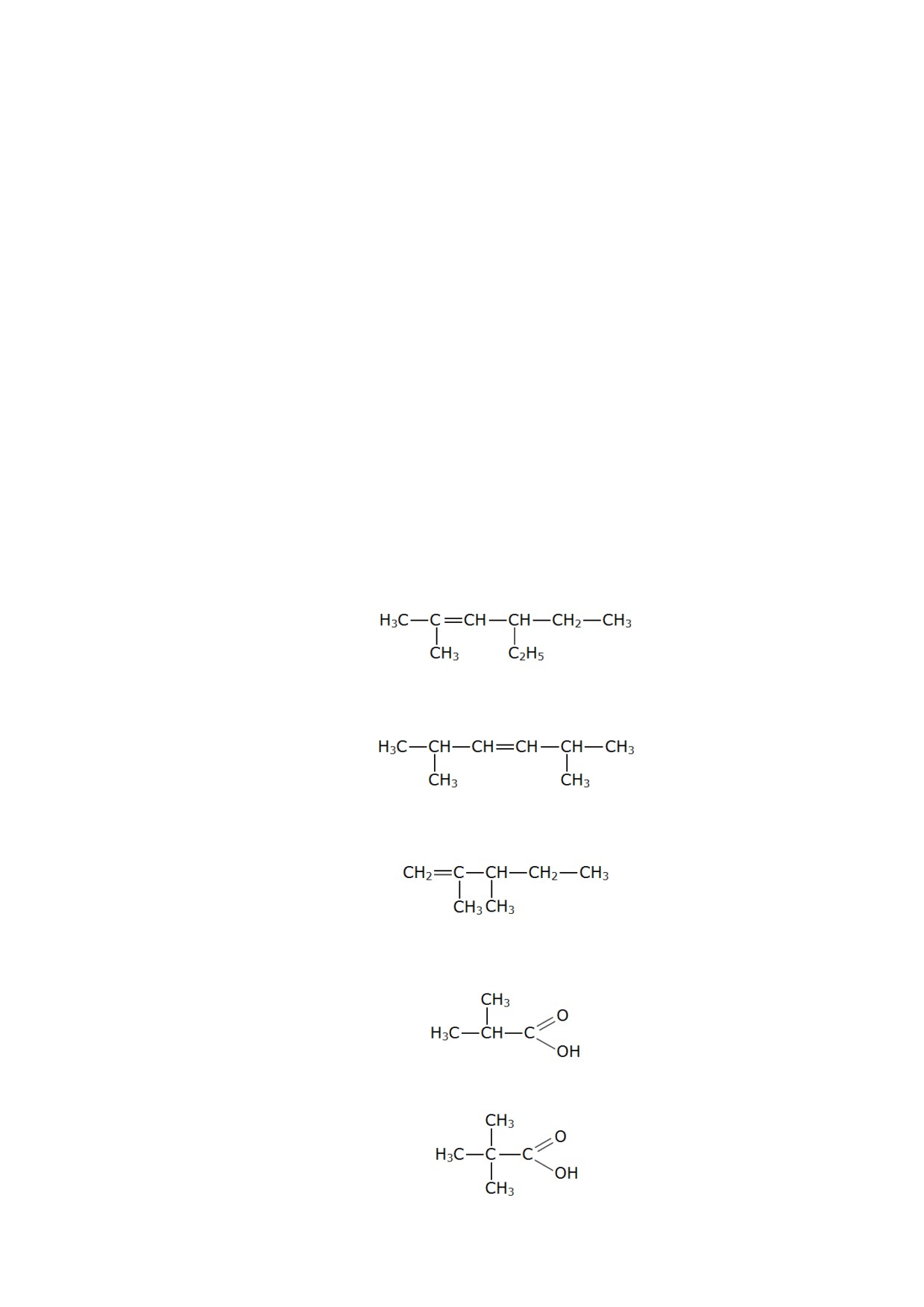
186. Составьте структурную формулу молекулы 3,3-диметилпентена-1.
187. Составьте структурную формулу молекулы 2,3-диметилпентена-2.
188. Составьте структурную формулу 3,4-диметилпентена-1.
189. Составьте структурную формулу 2-метилпропаналя.
190. Составьте структурную формулу 2-метилпентанола-1.
191. Составьте структурную формулу молекулы 2-метилбутадиена-1,3.
192. Составьте структурную формулу молекулы 3,4-диметилпентанола-2.
193. Составьте структурную формулу 2,2-диметилбутаналя.
194. Составьте структурную формулу 2,3-диметилпентана.
195. Составьте структурную формулу 2-метилбутанола-1.
196. Изобразите структурную формулу 3-метил-4-этилгексина-1.
197. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
198. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
199. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
200. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
201. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:

202. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
203. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
204. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
205. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
206. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
207. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
208. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
209. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:

210. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
211. Укажите молекулярную формулу вещества, при гидролизе которого образуется
глюкоза и фруктоза.
212. Укажите молекулярную формулу восьмого члена гомологического ряда алканов.
213. Укажите вещество, которое образуется в результате тримеризации ацетилена.
214. Напишите формулу метиламина.
215. Напишите общую формулу членов гомологического ряда,
к которому
принадлежит бутен-1.
216. Напишите общую формулу гомологического ряда, к которому
принадлежит
бутин-1.
217. Укажите общую формулу гомологического ряда, к которому
принадлежит
C2H5OH.
218. Укажите общую формулу членов гомологического ряда,
к которому
принадлежит октан.
219. Укажите общую формулу членов гомологического ряда,
к которому
принадлежит C10H22.
220. Укажите общую формулу гомологического ряда, к которому
принадлежит
CH3OH.
221. Напишите общую формулу гомологического ряда, к которому
принадлежит
пентин-1.
222. Укажите общую формулу гомологического ряда, к которому
принадлежит
бутадиен-1,3.
223. Среди предложенных формул: С2Н4, С3Н8, С3Н4, С6Н6 укажите гомолог этина.
224. Напишите названия веществ - продуктов гидролиза сахарозы.
225. Укажите, к какому классу углеводородов относится соединение с формулой
C2H2.
226. К какому классу углеводородов относится соединение с формулой C6H6?
227. Укажите класс органических соединений, к которым принадлежит метанол.
228. Укажите, к какому классу органических соединений относится (СН3)3N.
229. Укажите, к какому классу органических соединений относится анилин.
230. Укажите, к какому классу органических соединений относится вещество,
которое образуется в результате присоединения воды к ацетилену в присутствии солей
ртути.
231. Укажите, к какому классу органических соединений относится глицерин.
232. Укажите, к какому классу органических соединений относится вещество,
которое образуется в результате тримеризации ацетилена.
233. К какому классу непредельных углеводородов относится соединение с
формулой СН2=СН−СН3?
234. Укажите, к какому классу непредельных углеводородов относится соединение с
формулой C2H2.
235. Укажите функциональную группу, которая является носителем основных
свойств аминокислот.
236. Напишите формулу радикала пропила.
237. Запишите название вещества, которое является основным составляющей
природного газа.
238. Выберите и напишите в ответе уравнение реакции соединения:
CaCO3 = CaO + CO2
NaCl + H2SO4 = NaНSO4 + HCl
Zn(OH)2 = ZnO + H2O
H2 + Cl2 = 2HCl
239. Определите и напишите в ответе уравнение реакции соединения, в результате
которой образуется нерастворимое вещество:
S + O2 = SO2
CO2 + CaO = CaCO3
P2O5 + 3H2O = 2H3PO4
4P + 5O2 = 2P2O5
240. Определите и напишите в ответе уравнение реакции разложения:
2NaOH + CO2 = Na2CO3 + H2O
2KClO3 = 2KCl + 3O2
CuSO4 + Fe = FeSO4 + Cu
Na2O + H2O = 2NaOH
241. Определите и напишите в ответе уравнение реакции разложения:
2NaOH + CO2 = Na2CO3 + H2O
2KClO3 = 2KCl + 3O2
MgO + SO2 = MgSO3
Na2O + H2O = 2NaOH
242. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуется газообразное вещество:
Zn + 2HCl = ZnCl2 + H2
2NaCl + H2SO4 = Na2SO4 + 2HCl
2KClO3 = 2KCl + 3O2
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
243. Запишите в ответе уравнение реакции разложения, в результате которой
образуются и простые и сложные вещества:
2Fe(OH)3 = Fe2O3 + 3H2O
2KMnO4 = K2MnO4 + MnO2 + O2
CH4 + 2O2 = CO2 + 2H2O
BaSiO3 = SiO2 + BaO
244. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуются только простые вещества:
2H2O = 2H2
+ O2
2KClO3 = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
CaCO3 = CaO + CO2
245. Определите и напишите в ответе уравнение реакции замещения:
4HNO3 = 2H2O + 4NO2 + O2
KOH + HCl = KCl + H2O
2Na + 2H2O = 2NaOH + H2
NaCl + AgNO3 = AgCl
+ NaNO3
246. Определите и напишите в ответе уравнение реакции замещения, в результате
которой выделяется газообразное вещество:
2Al + 6HCl = 2AlCl3 + 3H2
2HCl + Na2SO3 = 2NaCl + H2O + CO2
Zn + CuCl2 = Cu + ZnCl2
MgO + CO2 = MgCO3
247. Определите и напишите в ответе уравнение реакции обмена:
2NaCl + F2 = 2NaF + Cl2
NaOH + HNO3 = NaNO3 + H2O
2K + S = K2S
2Na + Cl2 = 2NaCl
248. Определите и напишите в ответе уравнение реакции обмена:
Fe + S = FeS
2Al + 6HCl = 2AlCl3 + 3H2
Na2O + CO2 = Na2CO3
2NaOH + CuCl2 = 2NaCl + Cu(OH)2
249. Определите и напишите в ответе уравнение реакции обмена,
в
результате
которой образуется осадок:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
2NaOH + H2SO4 = Na2SO4 + H2O
2NaNO3 =2NaNO2 +O2
250. Определите и напишите в ответе уравнение реакции обмена, в результате
которой образуется осадок:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
2KMnO4 = K2MnO4 + MnO2 + O2
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
2NaOH + H2SO4 = Na2SO4 + H2O
251. Определите и напишите в ответе уравнение реакции обмена, в результате
которой образуется нерастворимое вещество:
Na2O + 2HCl = 2NaCl + H2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2
SO2 + H2O = H2SO3
HCl + AgNO3 = AgCl + HNO3
252. Определите
и напишите в ответе уравнение окислительно-восстановительной
реакции:
SO3 + H2O = H2SO4
S + 2HNO3 (РАЗБ.) = H2SO4 + 2NO
2NaOH + H2SO4 = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
253. Определите
и запишите в ответе реакцию, которая является окислительно-
восстановительной:
CaO + SO2 = CaSO3
Cu(OH)2 = CuO + H2O
S + O2 = SO2
H2SO4 + BaCl2 = BaSO4
+ 2HCl
254. Определите
и запишите в ответе реакцию, которая является окислительно-
восстановительной:
Li2O + H2O = 2LiOH
BaCl2 + CuSO4 = BaSO4
+ CuCl2
C + O2 = CO2
AgNO3 + KBr = AgBr
+ KNO3
255. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
2H2 + O2 = 2H2O
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
256. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
Fe2O3 + 3CO = 2Fe + 3CO2
P2O5 + 5C = 5CO + 2P
CuO + CO = Cu + CO2
BaO + CO2 = BaCO3
257. Определите и напишите в ответе уравнение некаталитической реакции:
N2 + 3H2 Fe
2NН3
MnO
2
2H2O2
2H2O + O2
KOH + HCl = KCl + H2O
С6Н12О6 ферменты
2C2H5OH + 2СО2
258. Определите и напишите в ответе уравнение эндотермической реакции:
N2 + 3Н2 = 2NН3 + Q
CaCO3 = CaO + CO2 - Q
259. Определите и напишите в ответе уравнение эндотермической реакции:
СaO + 3C = CaC2 + CO - Q
C4H8 + H2 = C4H10 + Q
260. Определите и напишите в ответе уравнение экзотермической реакции:
СaO + 3C = CaC2 + CO - Q
C3H6 + H2 = C3H8 + Q
261. Определите и напишите в ответе уравнение реакции,
являющейся
экзотермической:
S+ O2= SO2 + Q
СаСО3 = СаО + СО2 - Q
262. Определите и напишите в ответе уравнение реакции,
являющейся
экзотермической:
FeO + CO = Fe + CO2 + Q
СаСО3 = СаО + СО2 - Q
263.
Определите вещество Х и запишите в ответе его название:
t°
2Fe(OH)3
X + 3H2O
264.
Определите вещество Х и запишите в ответе его название:
Al(OH)3 + 3HCl = X + 3H2O
265.
Определите вещество Х и запишите в ответе его название:
4NH3 + 5O2
4Х + 6H2O
266.
Определите вещество Х и запишите в ответе его название:
Cu + X CuSO4 + SO2 + H2O
267.
Определите вещество Х и запишите в ответе его название:
СаСО3 + 2HCl = CaCl2 + H2O + X
268.
Определите вещество Х и запишите в ответе его название:
СaC2 + 2H2O = C2H2 + X
269.
Определите вещество Х и напишите в ответе его систематическое название:
Al4C3 + 12H2O = 4Al(OH)3 + 3X
270.
Определите вещество Х и запишите в ответе его название:
1000°C
СН4
Х + 2Н2
271.
Определите вещество Х и запишите в ответе его систематическое название:
CH4 X C6H6
272.
Определите вещество Х и напишите в ответе его систематическое название:
2CН3Cl + 2Na
2NaCl + Х
273.
Определите вещество Х и запишите в ответе его название:
СН3−СН2−Br + NaOH(спиртовой раствор) Х + NaBr + Н2О
274.
Определите вещество Х и запишите в ответе его название:
CH3−CH2−Br + NaOH(водный раствор) NaBr + X
275.
Определите вещество Х и напишите в ответе его название:
+
H
СН2=СН2 + НОН
Х
276.
Определите вещество Х и запишите в ответе его название:
СН2=СН−СН3 + НСl Х
277.
Определите вещество Х и запишите в ответе его систематическое название:
+
H
СН2=СН−СН3 + НОН
Х
278.
Определите вещество Х и запишите в ответе его название:
НС≡СН + 2Н2 Х
279.
Определите вещество Х в схеме превращений и напишите в ответе
его
систематическое название:
С2Н2 Х СН3СООН
280. Определите вещество Х и запишите в ответе его название по систематической
номенклатуре:
2+
Hg
HC≡CH + H2O
X
281. Определите вещество Х и запишите в ответе его название, если известно, что
исходные вещества взаимодействуют в соотношении 1:1:
СН≡С−СН3 + HBr X
282. Определите вещество Х и запишите в ответе его название:
600°С, Сакт
3СН≡СН
Х
283. Определите вещество Х и запишите в ответе его систематическое название:
C6H6 + Cl2 h
X
284. Определите вещество Х в схеме превращений и напишите в ответе его
систематическое название:
C6H5Cl X C6H5COOH
285. Определите вещество Х и запишите в ответе его название:
СН3СНО + Н2 Х
286. Определите вещество Х и запишите в ответе его название:
>140°C
С2Н5ОН
Х + Н2О
287. Определите вещество Х и запишите в ответе его название по систематической
номенклатуре:
2
4
C6H5OH + 3HO−NO2
3H2O + X
288.
Определите вещество Х и запишите в ответе его систематическое название:
Х + CuO CH3CHO + Cu + H2O
289.
Определите вещество Х и запишите в ответе его название:
СН3СООNa + NaOH Na2CO3 + X
290.
Определите вещество Х и запишите в ответе его название:
С6Н12О6 ферменты Х + 2СО2
291.
Вычислите относительную молекулярную массу кристаллогидрата CuSO4·5Н2O.
292.
Вычислите молярную массу Na[Al(OH)4].
293.
Вычислите молярную массу глюкозы.
294.
Вычислите молярную массу сахарозы.
295.
Вычислите молярную массу кристаллогидрата CuSO4 5Н2O.
296.
Вычислите молярную массу кристаллогидрата FeSO4 7Н2O?
297.
Масса некоторого соединения, взятого количеством вещества 0,002 моль, равна
128 мг. Рассчитайте молярную массу этого вещества.
298. Определите массу 0,5 моль CuSO4·5H2O.
299. Вычислите массу Na[Al(OH)4] количеством вещества 1 моль.
300. Вычислите массу кислорода в SO2 количеством вещества 0,5 моль.
301. Вычислите массу SO2 количеством вещества 0,25 моль.
302. Определите массу 0,4 моль Mg3N2.
303. Определите массу 5 моль Zn3N2.
304. Определите массу 5 моль Zn3(РО4)2.
305. Вычислите массу 18,06·1023 атомов натрия.
306.
Вычислите массу 12,04·1023 атомов кальция.
307.
Сколько моль сульфида железа (II) содержится в 17,6 г FeS?
308.
Сколько моль сульфида железа (II) содержится в 8,8 г FeS?
309.
Определите количество вещества сульфата калия массой 87 г.
310.
Определите количество вещества фосфата натрия массой 82 г.
311.
Определите количество молекул воды, содержащхся в 72 г воды.
312.
Определите количество молекул воды, содержащхся в 36 г воды.
313.
Вычислите, сколько молекул содержится в 3,4 г аммиака.
314.
Вычислите, сколько молекул содержится в 0,85 г аммиака.
315.
Определите число атомов водорода в сернистой кислоте количеством вещества
20 моль.
316.
Определите число атомов водорода в сернистой кислоте количеством вещества
10 моль.
317.
Определите число атомов кислорода в озоне количеством вещества 0,3 моль.
318.
Определите число атомов водорода в сероводороде количеством вещества
2 моль.
319.
Определите число атомов водорода в сероводороде количеством вещества
5 моль.
320.
Определите число атомов водорода в гидроксиде кальция количеством вещества
5 моль.
321.
Определите количество атомов кислорода в гидроксиде кальция количеством
вещества 10 моль.
322. Определите объем 18,06·1023 молекул водорода (при н.у.).
323. Определите объем 12,04·1023 молекул водорода (при н.у.)
324. Определите объем 4 моль аммиака при н.у.
325. Определите объем 3 моль аммиака при н.у.
326. Вычислите объем углекислого газа (н.у.) количеством вещества 0,3 моль.
327. Вычислите объем углекислого газа (н.у.) количеством вещества 4 моль.
328. Укажите, во сколько раз масса 2,75 моль сернистого газа больше, чем масса
2 моль углекислого газа.
329. Плотность некоторого газа по воздуху равна
2. Определите, чему равна
плотность этого газа по водороду.
330. Сделайте необходимые вычисления и укажите относительную молекулярную
массу некоторого газа, относительная плотность которого по кислороду 1,5.
331. Составьте уравнение химической реакции между оксидом лития и водой. В
ответе укажите коэффициент возле формулы продукта реакции.
332. Составьте уравнение химической реакции между соляной кислотой и оксидом
алюминия с образованием средней соли. В ответе укажите сумму всех коэффициентов.
333. Составьте уравнение химической реакции между соляной кислотой и
гидроксидом алюминия. В ответе укажите сумму всех коэффициентов.
334. Составьте уравнение химической реакции каталитического окисления оксида
серы (IV). В ответе укажите сумму всех коэффициентов.
335. Составьте уравнение химической реакции между соляной кислотой и магнием. В
ответе укажите сумму всех коэффициентов.
336. Составьте уравнение химической реакции между соляной кислотой и магнием. В
ответе укажите коэффициент перед формулой соляной кислоты.
337. Составьте уравнение химической реакции между оксидом магния и
ортофосфорной кислотой с образованием средней соли. В ответе укажите сумму всех
коэффициентов.
338. Составьте уравнение химической реакции между кислородом и кальцием. В
ответе укажите сумму всех коэффициентов.
339. Составьте уравнение химической реакции между кислородом и кальцием. В
ответе укажите коэффициент возле формулы продукта реакции.
340. Составьте уравнение химической реакции между кислородом и угарным газом.
В ответе укажите коэффициент возле формулы продукта реакции.
341. Составьте уравнение химической реакции между кислородом и угарным газом.
В ответе укажите сумму всех коэффициентов.
342. Составьте уравнение химической реакции между кислородом и магнием.
В ответе укажите сумму всех коэффициентов.
343. Составьте уравнение химической реакции между кислородом
(взятым в
избытке) и фосфором. В ответе укажите сумму всех коэффициентов.
344. Составьте уравнение химической реакции между кислородом (в избытке) и
фосфором. В ответе укажите коэффициент возле формулы кислорода.
345. Составьте уравнение химической реакции между кислородом и магнием.
В ответе укажите коэффициент возле формулы продукта реакции.
346. Составьте уравнение химической реакции взаимодействия воды и натрия.
В ответе укажите коэффициент, стоящий перед формулой газообразного продукта реакции.
347. Составьте уравнение химической реакции горения этина. В ответе укажите
коэффициент перед формулой кислорода.
348. Составьте уравнение химической реакции между кислородом и серой. В ответе
укажите коэффициент возле формулы кислорода.
349. Составьте уравнение химической реакции между кислородом и алюминием.
В ответе укажите коэффициент возле формулы кислорода.
350. Составьте уравнение химической реакции между кислородом и алюминием.
В ответе укажите коэффициент возле формулы продукта реакции.
351. Составьте уравнение химической реакции между кислородом и углеродом при
недостатке кислорода. В ответе укажите коэффициент возле формулы продукта реакции.
352. Составьте уравнение химической реакции между нитратом серебра и хлоридом
натрия. В ответе укажите коэффициент возле формулы осадка.
353. Составьте уравнение химической реакции между оксидом серы (VΙ) и
гидроксидом натрия. В ответе укажите коэффициент возле формулы щелочи, учитывая, что
одним из продуктов реакции является средняя соль.
354. Составьте уравнение химической реакции между цинком и соляной кислотой.
В ответе укажите коэффициент возле формулы соли.
355. Составьте уравнение химической реакции разложения нитрата натрия. В ответе
укажите коэффициент возле формулы газообразного продукта реакции.
356. Составьте уравнение химической реакции термического разложения нитрата
серебра. В ответе укажите коэффициент возле формулы твердого продукта реакции.
357. Составьте уравнение химической реакции термического разложения нитрата
меди. В ответе укажите коэффициент возле формулы твердого продукта реакции.
358. Составьте уравнение химической реакции разложения гидроксида алюминия.
В ответе укажите коэффициент возле формулы реагента.
359. Составьте уравнение химической реакции между кислородом и сернистым
газом. В ответе укажите коэффициент возле формулы продукта реакции.
360. Составьте уравнение химической реакции горения метана. В ответе укажите
коэффициент возле формулы кислорода.
361. Составьте уравнение химической реакции между этеном и хлором. В ответе
укажите коэффициент перед формулой хлора.
362. Составьте уравнение химической реакции между этином и водородом, в
результате которой образуется гомолог метана. В ответе укажите коэффициент перед
формулой водорода.
363. Составьте уравнение химической реакции полного окисления этана. В ответе
укажите коэффициент перед формулой кислорода.
364. Составьте уравнение химической реакции между этином и хлором, в результате
которой образуется хлорпроизводное алкана. В ответе укажите коэффициент перед
формулой хлора.
365. Укажите соотношение между количествами веществ бензола и водорода в
уравнении химической реакции, продуктом которой является циклогексан.
366. Вычислите массовую долю кислорода (%) в соединении SO2.
367. Смесь массой
30 кг состоит из песка и почвы. Вычислите массу песка,
входящего в состав смеси, если известно, что массовая доля почвы в этой смеси равна 20%.
368. Определите массовую долю (%) углерода в метане.
369. Определите, в каком массовом отношении находятся натрий и кислород в
соединении, формула которого Na2O2.
370. Определите, в каком массовом отношении находятся медь и кислород в
соединении, формула которого CuO?
371. Вычислите массовую долю (%) химического элемента азота в оксиде азота (V).
(Число, являющееся ответом задачи, округлить до целого по правилам математического
округления.)
372. Вычислите массовую долю
(%) химического элемента фосфора в оксиде
фосфора (V).
(Число, являющееся ответом задачи, округлить до целого по правилам
математического округления.)
373. Определите массовую долю гидроксида натрия, если его раствор массой 60 г
содержит гидроксид натрия массой 6 г.
374. Определите массовою долю гидроксида натрия, если его раствор массой 120 г
содержит гидроксид натрия массой 24 г.
375. Определите массовою долю серной кислоты, если раствор массой
200 г
содержит кислоту массой 50 г.
376. В воде объёмом 350 мл растворили соль массой 50 г. Определите массовую
долю соли в полученном растворе, приняв плотность воды равной 1 г/мл.
377. В воде объёмом 200 мл растворили соль массой 50 г. Определите массовую
долю соли в полученном растворе, если плотность воды равна 1 г/мл.
378. Вычислить объем воды
(приняв плотность воды равной
1 г/мл), который
необходимо прилить к 15 г соли для того, чтобы получить 25%-ный раствор соли.
379. Вычислить объем воды
(приняв плотность воды равной
1 г/мл), который
необходимо прилить к 15 г соли для того, чтобы получить 25%-ный раствор соли.
380. Вычислите массы сульфата калия и воды, необходимых для приготовления
раствора массой 450 г с массовой долей K2SO4 6%?
381. Какие массы сульфата натрия и воды надо взять для приготовления 400 г
раствора с массовой долей Na2SO4 10%?
382. Какую массу сульфата натрия и воды надо взять для приготовления раствора
массой 240 г с массовой долей Na2SO4 9%?
383. Какую массу ортофосфата калия и воды надо взять для приготовления раствора
массой 250 г с массовой долей соли 8%?
384. Какую массу соли и воды надо взять для приготовления 300 г раствора с
массовой долей NaCl 15%?
385. Какую массу соли и воды надо взять для приготовления раствора массой 300 г с
массовой долей NaCl 8%?
386. Какую массу соли и воды надо взять для приготовления раствора массой 350 г с
массовой долей NaCl 12%?
387. Вычислите, какую массу воды необходимо прилить к 25 г сахара для того, чтобы
получить 10%-ный раствор сахара.
388. Вычислите массу соли, которую необходимо растворить в 50 г воды для того,
чтобы получить 20%-ный раствор соли.
389. Вычислите массу соли, которую необходимо растворить в 30 г воды для того,
чтобы получить 20%-ный раствор соли.
390. Определите массовую долю (в %) соли в растворе, полученном растворением
15 г соли в воде массой 45 г.
391. Определите массовою долю (в %) соли в растворе, если растворили 5 г соли в
воде массой 45 г.
392. Определите массовою долю соли в растворе, если в воде массой 85 г растворили
15 г соли.
393. Определите массу раствора, который образуется при растворении в 130 г воды
20 г кухонной соли.
394. Определите массу раствора, который образуется при растворении в 120 г воды
60 г кухонной соли.
395. Определите массу раствора, который образуется при растворении в 90 г воды
10 г кухонной соли.
396. Вычислите массу раствора, который образуется при растворении в 80 г воды 20 г
кухонной соли.
397. Вычислите массу раствора, который образуется при растворении в 170 г воды
40 г кухонной соли.
398. Установите соотношение масс элементов в соединении СО2.
399. Магний соединяется с серой в массовом соотношении 3:4. Укажите массы серы
и магния, необходимых для получения 140 г сульфида магния.
400. Медь соединяется с серой в соотношении 4:1. Сколько потребуется по массе
исходных простых веществ для получения 20 г сульфида меди (II).
401. Кальций соединяется с серой в соотношении 5:4. Сколько потребуется по массе
исходных веществ для получения 90 г сульфида кальция.
402. Кальций соединяется с серой в соотношении 5:4. Какие массы кальция и серы
потребуются для получения 180 г сульфида кальция?
403. Железо соединяется с серой в массовом отношении 7:4. Укажите массы железа и
серы, необходимых для получения из простых веществ 88 г сульфида железа (II).
404. Алюминий соединяется с серой в соотношении 9:16. Укажите массу алюминия и
массу серы, необходимых для получения 25 г сульфида алюминия.
405. Магний взаимодействует с кислородом в соотношении 3:2. Укажите массы
магния и кислорода, которые необходимы для получения 35 г оксида магния.
406. Кальций взаимодействует с кислородом в соотношении 5:2. Укажите массы
кальция и кислорода, которые необходимы для получения 112 г оксида кальция.
407. Чему равна масса железной окалины (Fe3O4), полученной окислением железа
массой 1,68 г кислородом массой 0,64 г?
408. При разложении 4,44 г малахита образуется
3,2 г СuO и 0,36 г воды Н2О.
Определите, какая масса углекислого газа СО2 образуется.
409. При нагревании Ag2O образовалось 43,2 г Ag и 3,2 г O2. Какова была масса
разложившегося оксида?
410. Определите массу углекислого газа, полученного прокаливанием
100 г
известняка, если известно, что в результате реакции получено 56 г оксида кальция.
411. С целью получения сульфида алюминия была подвергнута нагреванию на
воздухе смесь 54 г алюминия и 96 г серы. Вычислите массу продукта реакции.
412. С целью получения сульфида алюминия была подвергнута нагреванию на
воздухе смесь 27 г алюминия с 48 г серы. Вычислите массу продукта реакции.
413. Красный порошок меди массой 6,4 г смешали с желтым порошком серы массой
3,2 г и нагрели. Какова масса полученного черного порошка?
414. Сожгли 5 г серы, при этом образовался оксид серы (IV) массой 10 г. Вычислите,
какая масса кислорода прореагировала?
415. Сожгли
10 г серы, при этом образовался оксид серы (IV) массой
20 г.
Вычислите, какая масса кислорода прореагировала?
416. Сожгли 3,1 г фосфора, при этом образовался оксид фосфора (V) массой 7,1 г.
Какая масса кислорода прореагировала?
417. Сожгли
4 г кальция, при этом образовался оксид кальция массой
5,6 г.
Вычислите массу прореагировавшего кислорода.
418. Какая масса Р2О5 образовалась, если в 16 г кислорода сожгли 12,4 г фосфора?
419. Вычислите массу магния, вступившего в реакцию с кислородом массой 12 г,
если при этом образуется 30 г MgO.
420. Вычислите массу магния, вступившего в реакцию с кислородом массой 6 г, если
при этом образуется 15 г MgO.
421. Вычислите, какая масса водорода прореагировала с кислородом массой 16 г,
если образовалось 18 г воды?
422. При взаимодействии
10 г кальция с хлором образовалось
27,75 г продукта
реакции. Какая масса хлора прореагировала?
423. В результате разложения 98 г бертолетовой соли получили кислород и хлорид
калия массой 59,6 г. Определите массу кислорода, выделившегося в результате реакции.
424. Вычислите, какая масса оксида ртути (II) разложилась, если при этом
образовалось 32 г кислорода и 402 г ртути.
425. Вычислить количество вещества продукта реакции, образованного при
взаимодействии 2 моль алюминия с хлором.
426. При взаимодействии 27 г алюминия с кислородом образовался оксид алюминия
массой 51 г. Определите массу кислорода, вступившего в реакцию.
427.
20 г кальция вступило в реакцию с
8 г кислорода. Определите массу
полученного оксида кальция.
428.
10 г кальция вступило в реакцию с
4 г кислорода. Определите массу
полученного оксида кальция.
429. При сгорании 8 г метана образовалось 22 г углекислого газа и 18 г воды. Какая
масса кислорода участвовала в химической реакции?
430. Укажите объем продукта (при н.у.), который образуется при сгорании 5 л оксида
углерода (ІІ) в 2 л кислорода.
431. Вычислите объем кислорода (при н.у.), который потребуется для окисления 90 л
оксида углерода (II).
432. Определите объем хлора (при н.у.), который израсходовали для синтеза 50 л
хлороводорода.
433. Определите, какой объем газа останется не израсходованным в процессе
взаимодействия 56 л оксида серы (IV) и 48 л кислорода (н.у.).
434. Вычислите объем кислорода (при н.у.), который необходим для окисления 20 л
оксида азота (II).
435. Вычислите объем кислорода
(при н.у.), который потребуется для
каталитического окисления 180 л оксида серы (IV).
436. Вычислите объем кислорода (при н.у.), необходимый для получения оксида
серы (IV) из сероводорода объемом 89,6 л.
437. Вычислите количество вещества алюминия, который прореагирует с кислородом
количеством вещества 0,6 моль.
438. Вычислите количество вещества алюминия, который вступил в реакцию с серой,
если при этом образовалось 0,2 моль сульфида алюминия.
439. Определите объем водорода (при н.у.), который необходим для синтеза 200 л
аммиака.
440. Определите объем водорода (н.у.), который вступит в реакцию с азотом с
образованием 10 л аммиака.
441. Определите объем хлора (при н.у.), который израсходовали для синтеза 25 л
хлороводорода.
442. Определите объем хлороводорода (при н.у.), который можно получить из 40 л
хлора.
443. Определите объем хлороводорода (при н.у.), который можно получить из 120 л
хлора.
444. Вычислите объем кислорода
(при н.у.), который необходим для полного
окисления 20 л оксида азота (II).
445. Определите объем кислорода (н.у.), необходимый для полного сгорания 15 л
этана.
446. Определите объем кислорода (н.у.), необходимый для полного сгорания 10 л
этана.
447. Вычислите объем кислорода (при н.у.), необходимый для полного сгорания 40 л
бутана.
448. Вычислите объем кислорода (при н.у.), необходимый для полного сгорания 20 л
бутана.
449. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 100 л пропена.
450. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 60 л пропана.
451. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 120 л пропана.
452. Найдите объем оксида углерода (IV) (при н.у.), выделившегося при спиртовом
брожении 36 г глюкозы.
453. Вычислите объем углекислого газа
(н.у.), который выделится при полном
окислении 35 л ацетилена.
454. Вычислите объем углекислого газа
(н.у.), который выделится при полном
окислении 70 л ацетилена.
455. Определите объем углекислого газа (при н.у.), который образуется при сгорании
метана в 80 л кислорода.
456. Определите объем углекислого газа (при н.у.), который образуется при сгорании
метана в 40 л кислорода.
457. Определите объем азота
(н.у.), который выделится при сжигании
20 л
метиламина.
458. Определите объем ацетилена (при н.у.), для полного гидрирования которого
израсходовали 200 л водорода.
459. Определите объем ацетилена (при н.у.), для полного гидрирования которого
израсходовали 100 л водорода.
460. Определить объем ацетилена (при н.у.), который образуется при нагревании
140 л метана.
461. Определить объем ацетилена (при н.у.), который образуется при термическом
крекинге 280 л метана.
462. Определите объем хлора
(при н.у.), который потребуется для полного
хлорирования 120 л метана до тетрахлорметана.
463. Определите объем хлора
(при н.у.), который потребуется для полного
хлорирования 40 л метана до тетрахлорметана.
464. Вычислите объём углекислого газа
(н.у.), который выделится при полном
сгорании 6 л этина.
465. Определите объем этана
(при н.у.), который образуется при полном
гидрировании 360 л ацетилена.
466. Определите максимальный объем (при н.у.) бромоводорода, который может
присоединить 0,25 моль ацетилена.
467. Закончите предложение: «по правилу Вант-Гоффа с повышением температуры
на каждые 10°С скорость реакции ___________ª.
468. Реакция между двумя газообразными веществами проходит по уравнению
А2 + 2В = 2АВ. Как изменится скорость этой реакции при увеличении давления в 6 раз?
469. Вычислите температурный коэффициент скорости реакции
(значение,
показывающее во сколько раз возрастает скорость реакции при повышении температуры на
каждые 10°С), если при повышении температуры на 20°С скорость реакции возрастает в
9 раз.
470. Вычислите во сколько раз увеличивается скорость реакции при повышении
температуры с 50°С до 80°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
471. Вычислите во сколько раз увеличивается скорость реакции при повышении
температуры с 70°С до 90°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
472. При повышении температуры на каждые 10°С скорость химической реакции
возрастает в 2 раза. На сколько градусов надо увеличить температуру, чтобы скорость
реакции увеличилась в 16 раз?
473. На сколько градусов следует повысить температуру, чтобы скорость реакции
повысить в 81 раз, учитывая, что при повышении температуры на каждые 10°С скорость
реакции возрастает в 3 раза?
474. На сколько градусов следует повысить температуру, чтобы скорость реакции
повысить в 27 раз, учитывая, что при повышении температуры на каждые 10°С скорость
реакции возрастает в 3 раза?
475. Укажите, во сколько раз увеличится скорость химической реакции, если
повысить температуру от +20°С до +80°С, учитывая, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
476. Вычислите, во сколько раз увеличится скорость химической реакции при
увеличении температуры на 30°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
477. При повышении температуры на каждые 10°С скорость реакции возрастает в
2,8 раза. Во сколько раз возрастет скорость реакции при повышении температуры от 55°С до
75°С?
478. При повышении температуры на каждые 10°С скорость химической реакции
возрастает в 2,5 раза. Как изменится ее скорость при охлаждении реакционной смеси от
изменения температуры от 50°С до 30°С?
479. Во сколько раз увеличится скорость реакции, если повысить температуру на
20°С, если известно, что при повышении температуры на каждые 10°С скорость реакции
увеличивается в 2,3 раза?
480. Укажите, во сколько раз увеличится скорость реакции, если повысить
температуру от 10°С до 50°С, учитывая, что при повышении температуры на каждые 10°С
скорость реакции возрастает в 2 раза.
481. Вычислите, во сколько раз увеличится скорость химической реакции при
увеличении температуры на 40°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
482. Во сколько раз увеличится скорость реакции гидролиза сахарозы при
повышении температуры с 27°С до 47°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции возрастает в 3 раза?
483. Определите, как изменится скорость некоторой реакции при повышении
температуры от 10°С до 50°С, если известно, что при повышении температуры на каждые
10°С скорость реакции увеличивается в 3 раза.
484. Определите, как изменится скорость некоторой реакции при повышении
температуры от 0°С до 10°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
485. Реакция при температуре
50°С протекает за
180 с. Учитывая, что при
повышении температуры на каждые 10°С скорость реакции увеличивается в 3 раза, укажите
время протекания этой реакции при температуре 70°С.
486. Начальная скорость реакции при 40°С составляет 0,54 моль/л·мин. Вычислите
скорость этой реакции при температуре 50°С, если при повышении температуры на каждые
10°С скорость химической реакции возрастает в 3 раза.
487. При 150°С некоторая реакция заканчивается за 8 минут. Принимая, что при
повышении температуры на 10°С скорость реакции возрастает в 2 раза, определите, через
какое время закончится эта реакция, если проводить ее при 170°С.
488. В системе СО (г) + Сl2 (г)
СОСl2 (г) концентрацию угарного газа увеличили с
1,2 моль/л до 1,5 моль/л, а хлора - с 1,25 моль/л до 2 моль/л. Во сколько раз увеличилась
при этом скорость реакции?
489. Константа скорости реакции А + 2В = С, k = 0,1 л·моль−1·с−1. Определите
скорость реакции при концентрациях А = 4 моль/л и В = 3 моль/л.
490. Рассчитайте скорость реакции между растворами хлорида калия и нитрата
серебра, концентрации которых составляют соответственно
0,2 и
0,3 моль/л, а
k = 1,5·10−3 л·моль−1·с−1.
491. Средняя скорость разложения оксида азота (V) на простые вещества при 67°С
равна 0,25 моль/(л·мин). Определите время полураспада N2O5 при начальной концентрации
1 моль/л.
492. Вычислите среднюю скорость реакции CO + Cl2 = COCl2, если начальная
концентрация хлора была равна 1,2 моль/л, а через 6 секунд стала равной 0,6 моль/л.
493. Вычислите среднюю скорость реакции CO + Cl2 = COCl2, если начальная
концентрация хлора была равна 1 моль/л, а через 4 секунды стала равной 0,6 моль/л.
494. Вычислите среднюю скорость реакции CO + NO2 = CO2 + NO, если начальная
концентрация оксида углерода (ΙΙ) была равна 2 моль/л, а через 5 секунд стала 0,5 моль/л.
495. Определите среднюю скорость гомогенной реакции А + В = С, если начальная
концентрация вещества В была 0,84 моль/л, а через 20 секунд стала 0,62 моль/л.
496. Химическая реакция протекает в растворе согласно уравнению А + В = С.
Начальная концентрация вещества А составляла 0,80 моль/л, а вещества В - 1,00 моль/л.
Спустя 20 секунд концентрация А снизилась до 0,78 моль/л. Вычислите среднюю скорость
реакции.
497. Укажите, во сколько раз возрастет скорость реакции если повысить температуру
от 40°С до 70°С, если при увеличении температуры на каждые 10°С скорость реакции
увеличивается в 4 раза.
498. В начальный момент времени концентрация исходного вещества (х) была равна
2 моль/л. Определить концентрацию вещества (х) через одну минуту, если скорость реакции
равна 0,01 моль/л·сек.
499. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при повышении давления:
C3H8 (г) + 5O2 (г) ⇄ 3CO2 (г) + 4H2O (г)
500. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении температуры:
C (т) + 2N2O (г) ⇄ CO2 (г) + 2N2 (г) + Q
501. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении температуры:
C (т) + 2Cl2 (г) ⇄ CCl4 (г) + Q
502. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении давления:
CH4 (г) + 4S (т) ⇄ CS2 (г) + 2Н2S (г)
503. На основании принципа Ле Шателье, определите, в каком направлении
сместится равновесие в следующей системе при повышении давления (Т = const):
CH4 (г) + 4S (т) ⇄ CS2 (г) + 2Н2S (г)
504. Определите, в каком направлении сместится равновесие в следующей системе
при повышении давления:
2С2Н2 (г) + 5О2 (г) ⇄ 4СО2 (г) + 2Н2О (г) + 2610 кДж
505. В какую сторону сместится химическое равновесие реакции, уравнение которой
4HCl (г) + O2 (г) ⇄ 2H2O (г) + 2Cl2 (г) + Q
в случае увеличения давления?
506. В какую сторону сместится равновесие при увеличении концентрации кислорода
в системе:
2SO2 + O2 ⇄ 2SO3+ Q
507. В какую сторону сместится химическое равновесие в реакции, уравнение
которой
2CO + O2 ⇄ 2CO2 + Q,
в случае повышения температуры.
508. Укажите, как необходимо изменить температуру для того, чтобы сместить
равновесие реакции вправо:
2Nа (т) + Cl2 (г) ⇄ 2NаСl (т) + 411,3 кДж
509. Укажите, как необходимо изменить температуру протекания реакции для того,
чтобы сместить равновесие реакции в сторону продуктов реакции:
2НВr (г) ⇄ Н2 (г) + Вr2 (г) - Q
510. Укажите, как необходимо изменить концентрацию исходных веществ и
температуру для того, чтобы сместить вправо равновесие реакции:
N2 (г) + О2 (г) ⇄ 2NO (г) - Q
511. Укажите, как необходимо изменить давление для того, чтобы сместить
равновесие в сторону образования CO по реакции:
С (т) + СO2 (г) ⇄ 2СО (г)
512. Укажите, как необходимо изменить давление для того, чтобы сместить вправо
равновесие реакции:
N2 (г) + 3Н2 (г) ⇄ 2NH3 (г) + Q
513. Укажите, как необходимо изменить температуру для того, чтобы сместить
вправо равновесие реакции:
2H2S (г) + O2 (г) ⇄ 2H2O (г) + 2S (г) + Q
514. Укажите, как необходимо изменить температуру для того, чтобы сместить влево
равновесие реакции:
2H2S (г) + O2 (г) ⇄ 2H2O (г) + 2S (т) + Q
515. Укажите, как необходимо изменить температуру для того, чтобы сместить влево
равновесие реакции:
S (т) + 2СО2 (г) ⇄ SO2 (г) + 2СО - 269 кДж
516. Укажите, в какую сторону сместится равновесие реакции
Fe3O4 (т) + 4СO (г) ⇄ 3Fe (т) + 4СO2 (г) Н = +43,7 кДж
с повышением температуры.
517. Выберите и запишите в ответе уравнение, в котором при увеличении давления
химическое равновесие не смещается:
2H2 (г) + O2 (г) ⇄ 2H2O (г)
H2 (г) + Cl2 (г) ⇄ 2HCl (г)
518. Как нужно изменить концентрации реагирующих веществ в системе
СО (г) + Н2О (г) ⇄ СО2 (г) + Н2 (г),
чтобы увеличить выход продуктов реакции?
519. Эндотермическая реакция разложения пентахлорида фосфора протекает по
уравнению:
РСl5 (г) ⇄ РСl3 (г) + Сl2 (г) - 92,59 кДж.
Как надо изменить давление и температуру, чтобы сместить равновесие в сторону прямой
реакции - разложения РСl5?
520. Определите, увеличится ли выход продуктов при одновременном повышении
температуры и давления в системе:
6HF (г) + N2 (г) ⇄ 2NF3 (г) + 3H2 (г) - Q
521. Укажите факторы, способствующие смещению вправо равновесия реакции:
СО (г) + Н2O (г) ⇄ СО2 (г) + Н2 (г) + Q
522. Укажите, как повлияет снижение температуры на содержание NO2 в
равновесной системе:
2NO2 (г) ⇄ N2O4 (г) + Q
523. Теплота образования 1 моль оксида меди (ІІ) из простых веществ составляет
154,5 кДж. Определите, сколько выделится теплоты при взаимодействии
512 г меди с
кислородом.
524. При горении фосфора в избытке кислорода тепловой эффект реакции 3010 кДж.
Определите массу фосфора, если при сгорании выделилось 75,25 кДж теплоты.
525. При сгорании
2 моль цинка в кислороде выделяется
696 кДж теплоты.
Определите массу образца цинка, если при его сгорании выделилось 10,44 кДж теплоты.
526. При горении магния массой 1,2 г выделилось 31 кДж теплоты. Определите
тепловой эффект реакции.
527. В соответствии с термохимическим уравнением реакции:
2NаНСO3 = Nа2СO3 + СО2 + Н2O - 64 кДж
определите, какое количество теплоты затрачивается на превращение 126 г гидрокарбоната
натрия в карбонат натрия.
528. В соответствии с термохимическим уравнением реакции:
2NаНСO3 (т) = Nа2СO3 (т) + СО2 (г) + Н2O (г) - 64 кДж
определите, какое количество теплоты затрачивается на превращение 252 г гидрокарбоната
натрия в карбонат натрия.
529. В соответствии с термохимическим уравнением реакции:
2Са + O2 = 2СаО Н = -1274 кДж
Определите количество теплоты, выделившееся при сгорании 100 г кальция.
530. В соответствии с термохимическим уравнением реакции:
2Nа + Cl2 = 2NаСl + 411,3 кДж
определите количество теплоты, которое выделится при окислении 4 моль натрия в избытке
хлора.
531. В соответствии с термохимическим уравнением реакции:
2Nа (т) + Cl2 (г) ⇄ 2NаСl (т) + 411,3 кДж
Определите количество теплоты, которое выделится при окислении 8 моль натрия в избытке
хлора.
532. Определите количество теплоты, которое поглотится при окислении 48 г серы
по термохимическому уравнению реакции:
S + 2СО2 = SO2 + 2СО - 269 кДж
533. Определите количество теплоты, которое поглотится при окислении 96 г серы
по термохимическому уравнению реакции:
S (т) + 2СО2 (г) = SO2 (г) + 2СО - 269 кДж
534. Определите, сколько требуется затратить теплоты для получения 25 г железа
согласно уравнению:
Fe2O3 (т) + 3СО (г) ⇄ 2Fe (т) + 3СO2 (г) - 27 кДж
535. В соответствии с термохимическим уравнением
3Fe3O4 + 8Аl = 9Fe + 4Аl2O3 + Q
получили 1,68 г железа и при этом выделилось 11,08 кДж теплоты. Определите тепловой
эффект реакции.
536. По термохимическому уравнению
2NaOH + H2SO4 = Na2SO4 + 2H2O + 290 кДж
вычислите массу гидроксида натрия, вступившего в реакцию, если известно, что при его
нейтрализации выделилось 725 кДж теплоты.
537. По термохимическому уравнению
2KNO3 = 2KNO2 + O2 - 255 кДж
вычислите количество теплоты, которая поглотится при получении кислорода (н.у.) объемом
6,72 л.
538. Рассчитайте, сколько выделится теплоты при образовании
44,8 л (н.у.)
газообразного аммиака согласно термохимическому уравнению:
N2 + 3Н2 = 2NH3 + 92 кДж
539. Вычислите количество теплоты, которое выделится при каталитическом
окислении 89,6 л аммиака по термохимическому уравнению реакции:
4NH3 + 5O2 = 4NO + 6H2O + 1169 кДж
540. В результате реакции, термохимическое уравнение которой
CaO (т) + H2O (ж) = Ca(OH)2 (т) + 70 кДж,
выделилось 210 кДж теплоты. Вычислите массу образовавшегося при этом гидроксида
кальция.
541. В результате реакции, термохимическое уравнение которой
NН4NO2 = N2 + 2H2O + 316 кДж
выделилось 94,8 кДж теплоты. Определите массу разложившейся соли.
542. Сколько выделится теплоты при разложении
36,6 г оксида хлора (VІІ) в
соответствии с термохимическим уравнением реакции:
2Сl2О7 = 2Сl2 + 7О2 + 570 кДж
543. В результате реакции, термохимическое уравнение которой
2AgNO3 = 2Ag + 2NO2 + O2 - 317 кДж
поглотилось 15,85 кДж теплоты. Вычислите массу выделившегося серебра.
544. В соответствии с термохимическим уравнением реакции
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
определите объем метана, при сгорании которого выделяется 2200 кДж теплоты.
545. В соответствии с термохимическим уравнением реакции
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г) + 880 кДж
определите объем метана, при сгорании которого выделяется 1762 кДж теплоты.
546. В соответствии с термохимическим уравнением реакции
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
определите количество теплоты, выделившееся при окислении 89,6 л метана.
547. Согласно термохимическому уравнению реакции
СН4 (г) + 2O2 (г СO2 (г) + 2Н2O (ж) + 802 кДж
определите количество теплоты, выделившейся при сжигании 48 г метана.
548. В результате реакции, термохимическое уравнение которой
2С2Н2 + 5O2 = 4СO2 + 2Н2O + 2610 кДж,
выделилось 6525 кДж теплоты. Определите объем сгоревшего ацетилена
549. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж
выделилось 687 кДж теплоты. Вычислите количество вещества этанола.
550. Определите количество вещества этанола, если в результате
реакции,
термохимическое уравнение которой
С2Н5ОН (ж) + 3O2 (г)
2СO2 (г) + 3Н2O (г) + 1374 кДж
выделилось 68,7 кДж теплоты.
551. Определите количество вещества этанола, вступившего в реакцию, если в
результате реакции, термохимическое уравнение которой
С2Н5ОН + 3O2 = 2СO2 + 3Н2O + 1374 кДж,
выделилось 137,4 кДж теплоты.
552. В соответствии с термохимическим уравнением
С6Н12O6 + 6O2 = 6CO2 + 6H2O + 2800 кДж
определите, какое количество теплоты выделится при образовании 2,4 моль углекислого
газа.
553. В соответствии с термохимическим уравнением
С6Н12O6 (т) + 6O2 (г)
6CO2 (г) + 6H2O (г) + 2800 кДж
Определите, какое количество теплоты выделится при образовании 1,2 моль углекислого
газа.
Задания открытой формы с кратким ответом
Задание. Дайте правильный ответ.
1. Укажите, какое из перечисленных явлений: скисание молока, горение природного
газа, плавление металла, ржавление железа, относится к физическим.
2. Из предложенного перечня явлений: образование инея, таяние льда, ржавление
железной проволоки, плавление олова выпишите только химическую реакцию.
3. Укажите, какое из предложенных газообразных веществ: углекислый газ, хлор,
водород, этилен, следует получать в вытяжном шкафу.
4. Среди предложенных веществ H2S, S8, SО2, H2SО4 определите простое вещество.
5. Среди предложенных веществ HF, O3, CО2, H3PО4 определите простое вещество.
6. Какой из элементов проявляет постоянную валентность: P, Na, Cr, Fe?
7. Укажите, какой из элементов проявляет постоянную валентность: S, K, Cr, Fe.
8. Укажите валентность серы в SO3.
9. Укажите валентность серы в SO2.
10. Какой из химических элементов проявляет в соединениях валентность III: Ba, Al,
Ca, S?
11. Какой из химических элементов проявляет в соединениях валентность III: Ba, Al,
C, S?
12. Составьте формулу оксида серы, учитывая, что сера в нем проявляет
максимальную валентность.
13. Определите, в каком из соединений: N2H4, NH3, NH4Cl, N2O5, азот проявляет
валентность ΙV и степень окисления -3.
14. Определите, в каком из соединений: NF3, NH3, N2O3, AlCl3, степени окисления
химических элементов равны -3 и +1.
15. Определите, в каком из соединений: N2H4, NH3, NH4Cl, HNO3, химический
элемент азот проявляет степень окисления +5.
16. В каком из соединений: N2O5; NH3; HNO3; NO, химический элемент азот
проявляет наименьшую степень окисления?
17. В каком из соединений: N2O5, HNO2, NH3, NO2, химический элемент азот
проявляет наименьшую степень окисления?
18. В каком из соединений: NO2, HNO3, NO, NH3 химический элемент азот проявляет
наименьшую степень окисления?
19. В каком из соединений с серой: Na2S, MgS, Fe2S3, Al2S3, металлический элемент
проявляет наименьшую степень окисления?
20. В каком из соединений с серой: K2S, CaS, Fe2S3, Al2S3, металлический элемент
проявляет наименьшую степень окисления?
21. В каком из соединений с серой: K2S, CaS, S2Cl2, Al2S3, металлический элемент
проявляет наименьшую степень окисления?
22. Из предложенных веществ: FeO, PbO2, Cr2O3, Na2O, укажите соединение, в
котором степень окисления металлического элемента равна +1.
23. Из предложенных веществ: Fe2O3, PbO2, CrO3, Li2O, укажите соединение, в
котором степень окисления металлического элемента равна +1.
24. Укажите степень окисления азота в соединениях, которые образуются при
взаимодействии азота с активными металлами.
25. Укажите формулу вещества из предложенных: S, H2SO3, K2S, SO3, в котором сера
проявляет минимальную степень окисления.
26. Укажите формулу вещества из предложенных: S, H2SO4, H2S, SO2, в котором сера
проявляет минимальную степень окисления.
27. Определите степень окисления углерода в соединении Na2СO3.
28. Какой из указанных химических элементов: Mg, S, F, Na, проявляет наибольшую
степень окисления в соединениях с кислородом?
29. Какой из указанных химических элементов: Al, P, F, K, проявляет наибольшую
степень окисления в соединениях с кислородом?
30. Какую степень окисления проявляет сера в соединении с водородом?
31. Определите степень окисления серы в соединении Na2SO4.
32. Напишите формулу бинарного соединения, образованного элементом
А (VIIА группа) в низшей степени окисления и элементом В (II группа).
33. Напишите формулу бинарного соединения, образованного элементом
А (VI группа) в низшей степени окисления и элементом В (III группа).
34. Напишите формулу бинарного соединения, образованного элементом
А (IV группа) в низшей степени окисления и элементом В (III группа).
35. Напишите формулу бинарного соединения, образованного элементом
Х (VIА группа) в низшей степени окисления и элементом Y (III группа).
36. Напишите формулу бинарного соединения, образованного элементом
А (VIIА группа) в низшей степени окисления и элементом В (II группа).
37. Напишите общую формулу оксидов элементов VIА группы периодической
системы Д.И. Менделеева.
38. Напишите общую формулу оксидов элементов V группы периодической системы
Д.И. Менделеева.
39. Напишите общую формулу высших оксидов химических элементов VIА группы
периодической системы Д.И. Менделеева.
40. Укажите в ряду: F, Cl, Mn, Br один химический элемент, который отличается от
остальных по положению в периодической системе химических элементов Д.И. Менделеева.
41. Укажите, какой из элементов: фтор, сера, хлор, иод, не образует соединения в
высшей степени окисления, равной номеру группы.
42. Укажите номера периодов периодической системы, в которых находятся
f-элементы.
43. В каких группах периодической системы содержится только по одному элементу-
неметаллу?
44. Среди предложенных: Be, B, Li, F, укажите химический элемент, у которого
наибольший атомный радиус.
45. Среди предложенных: Mg, Na, S, Al, укажите химический элемент, у которого
наибольший атомный радиус.
46. Укажите наиболее электроотрицательный химический элемент среди элементов
VI А группы периодической системы.
47. Укажите среди предложенных химических элементов: Ne, F, Li, N, наиболее
активный неметаллический элемент второго периода периодической системы.
48. Из предложенных химических элементов Al, S, Cl, P, выберите элемент, который
проявляет наиболее ярко выраженные неметаллические свойства.
49. Укажите, у какого из химических элементов: Li, Al, Са, Na, наиболее выражены
металлические свойства.
50. Напишите, у какого из химических элементов: Li, Fe, Mg, Na, наиболее выражены
металлические свойства?
51. Укажите, у какого из предложенных химических элементов: Rb, Sr, Cs, K,
наиболее выражены металлические свойства.
52. Укажите, у какого из химических элементов: Ba, Be, Са, Mg, наиболее выражены
металлические свойства.
53. Какой из предложенных химических элементов: Si, P, S, Cl, обладает наибольшей
окислительной активностью?
54. Какой из предложенных химических элементов: Si, P, S, Cl, обладает наибольшей
восстановительной активностью?
55. Напишите в ответе от атома какого элемента - лития или калия - легче оторвать
электрон внешнего слоя?
56. Напишите чему равно число принятых электронов согласно схеме:
N+5 + nē N−3
57. Выберите из предложенных схем Са0 Са2+; Са2+ Са0, схему превращения, в
которой металл проявляет восстановительные свойства.
58. Выберите из предложенных схем Nа0 Nа+; Nа+ Nа0, схему превращения, в
которой металл проявляет восстановительные свойства.
59. Определите число энергетических уровней и число электронов на внешнем
энергетическом уровне атома магния.
60. Определите число энергетических уровней и число электронов на внешнем
энергетическом уровне атома кальция.
61. Определите число энергетических уровней и число электронов на внешнем
энергетическом уровне атома серы.
62. Укажите для атома хлора заряд ядра и число электронов на внешнем
энергетическом уровне.
63. Укажите для атома фтора заряд ядра и число электронов на внешнем
энергетическом уровне.
64. Определите у атома фосфора заряд ядра и число электронов на внешнем
энергетическом уровне.
65. Укажите максимальное количество электронов на d-подуровне.
66. Из предложенных химических элементов: алюминий, хлор, фосфор, бор,
определите атом, который в невозбужденном состоянии содержит три неспаренных
электрона.
67. В атоме химического элемента всего 6 s-электронов и 9 p-электронов. Сколько
электронов на его внешнем энергетическом уровне?
68. В атоме химического элемента всего 6 s-электронов и 10 p-электронов. Сколько
электронов на его внешнем энергетическом уровне?
69. В атоме химического элемента всего 6 s-электронов и 11 p-электронов. Сколько
электронов на его внешнем энергетическом уровне?
70. Определите химический элемент по электронной конфигурации его атома
1s22s22p63s23p4.
71. Определите химический элемент по электронной конфигурации его атома
1s22s22p63s23p64s1.
72. Определите химический элемент по электронной конфигурации 1s22s22p63s23p5.
73. Определите, атом какого химического элемента имеет электронную формулу
1s22s22p63s23p2.
74. Определите, атом какого химического элемента имеет электронную формулу
1s22s22p63s23p64s2.
75. Определите, у атома, какого элемента электронная формула 1s22s22p63s23p1.
76. Укажите, какое из предложенных водородных соединений: СН4, SiH4, H2S, H2O,
может образовать элемент, электронная конфигурация атома которого 1s22s22p63s23p4.
77. Укажите, какое из предложенных водородных соединений: NH3, SiH4, H2S, HCl,
может образовать элемент, электронная конфигурация атома которого 1s22s22p63s23p2.
78. Укажите электронную формулу внешнего энергетического уровня атома фосфора.
79. Укажите электронную формулу внешнего энергетического уровня атома
углерода.
80. Укажите электронную формулу внешнего энергетического уровня атома хлора.
81. Укажите, какой из атомов: углерод, фосфор, кальций или кислород, имеет
сходную электронную конфигурацию внешнего энергетического уровня с атомом азота.
82. Определите, электронная конфигурация какой из предложенных частиц: Са2+, K0,
Сl+, N3−, соответствует электронной конфигурации атома аргона.
83. Определите, электронная конфигурация какой из предложенных частиц: Са0, K+,
Сl+, Zn2+, соответствует электронной конфигурации атома аргона.
84. Какая из частиц: F0, Li+, О0, Na+ имеет такую же электронную конфигурацию, что
и атом неона?
85. Укажите электронную конфигурацию внешнего энергетического уровня атомов
щелочных металлов.
86. Определите число нейтронов в атоме изотопа 37Cl.
87. Определите число нейтронов в атоме изотопа 26Mg.
88. Определите число нейтронов в ядре атома нуклида ванадия 51V.
89. Чему равна сумма нейтронов и протонов в атоме 65Zn?
90. В каком из предложенных нуклидов: 56Fe, 126I, 58Co, 12C, содержится одинаковое
число протонов и нейтронов?
91. Состав драгоценного камня изумруда описывает формула BexAl2(SiO3)6. Исходя
из электронейтральности вещества, определите и укажите индекс x в этой формуле.
92. Укажите, какой из металлов: Pb, Mg, K или Fe реагирует с водой при 20°С с
наибольшей скоростью.
93. Какое водородное соединение: CH4, NH3, H2O, HCl окрашивает водный раствор
лакмуса в синий цвет?
94. Напишите в ответе ион, который содержится в растворе, если известно, что в этом
растворе цвет универсальной индикаторной бумаги изменяется на красный.
95. Напишите общую формулу водородного соединения, которые образуются при
взаимодействии элементов VIIA группы периодической системы с водородом.
96. Напишите общую формулу водородных соединений, которые образуются при
взаимодействии химических элементов VIA группы периодической системы с водородом.
97. Напишите общую формулу водородных соединений, которые образуются при
взаимодействии химических элементов VA группы периодической системы с водородом.
98. Напишите формулу высшего оксида химического элемента, который образует
летучее водородное соединение состава Н2Э.
99. Напишите формулу высшего оксида химического элемента, который образует
летучее водородное соединение состава НЭ.
100.Напишите формулу высшего оксида химического элемента с протонным числом
16.
101.Напишите высший оксид элемента с протонным числом 17.
102.Напишите высший оксид элемента с протонным числом 6.
103.Укажите сумму протонных чисел атомов натрия и кальция.
104.Укажите сумму протонных чисел атомов калия и магния.
105.Укажите сумму протонных чисел атомов магния и кальция.
106.Укажите сумму индексов в формуле высшего оксида химического элемента,
протонное число которого 34.
107.Укажите сумму индексов в формуле высшего оксида химического элемента,
протонное число которого 17.
108.Укажите протонное число химического элемента, который расположен в 4-м
периоде, VII-А подгруппе.
109.Укажите протонное число химического элемента, который расположен в 4-м
периоде, III-А подгруппе.
110.Напишите формулу оксида, если его образует элемент с порядковым номером 11.
111.Среди предложенных формул: Na2O, Al2O3, CO2, CO, укажите основный оксид.
112.Среди предложенных формул: Na2O, Al2O3, CO2, H2CO3, укажите основный оксид.
113.Среди предложенных формул: Fe2O3, CaO, NO2, CO, укажите основный оксид.
114.Среди предложенных формул: Cl2O7, P2O5, N2O, SO3 укажите несолеобразующий
оксид.
115.Среди предложенных формул: SO2, P2O5, CO, SO3.укажите несолеобразующий
оксид.
116.Укажите, какой из оксидов: SiO2, NO2, Аl2O3, SO2, относится к амфотерным.
117.Какой из оксидов: SiO2, NO2, ZnO, SO2, относится к амфотерным?
118.Укажите, какой из оксидов: BaO, SO3, Al2O3, SiO2, относится к амфотерным.
119. Какой из оксидов: K2O, SO3, Al2O3, MgO, может реагировать и с кислотами и со
щелочами?
120. Какой из оксидов: Na2O, P2O5 CaO, Al2O3, может реагировать и с кислотами и со
щелочами?
121. Определите в предложенном перечне веществ: Na2O, CO, NO2, ZnO, оксид,
который при взаимодействии с водой образует щелочь.
122. Определите в предложенном перечне веществ: SO3, NO2, Al2O3, K2O, оксид,
который при взаимодействии с водой образует щелочь.
123. Какой из оксидов: SiO2, CO, Nа2O, SО2 при взаимодействии с водой образует
кислоту?
124. Укажите, какой из оксидов: Mn2O7, Mn2O3, MnO, MnO2, обладает наиболее
выраженными основными свойствами.
125. Какой из оксидов: Сu2O, SO3, Al2O3, MgO, обладает ярко выраженными
кислотными свойствами?
126. Среди предложенных формул: CuOH, Fe(OH)2, Fe(OH)3, KOH, укажите щелочь.
127. Среди предложенных формул: Al(OH)3, KOH, Cu(OH)2, Fe(OH)2, укажите
щелочь.
128. Среди предложенных формул веществ: Cu(OH)2, NaOH, Fe(OH)2, Mg(OH)2,
укажите щелочь.
129. Среди предложенных формул: NaOH, Zn(OH)2, Ca(OH)2, KOH, укажите
амфотерный гидроксид.
130. Среди предложенных формул: NaOH, Al(OH)3, Ca(OH)2, KOH, укажите
амфотерное основание.
131. Среди предложенных веществ Na2O, Zn(OH)2, Ca(OH)2, Al2O3, укажите
амфотерный гидроксид.
132. Среди предложенных формул: Mg(OH)2, Zn(OH)2, Ba(OH)2, KOH, укажите
амфотерный гидроксид.
133. Напишите формулу кислоты, образованной элементом, которому соответствует
высший оксид состава Э2О5.
134. Среди предложенных формул: H2S, H2SO3, H2SO4, HNO3, определите
одноосновную кислоту.
135. Среди предложенных формул кислот: H3PO4, HClO4, H2СO3, HCl укажите
двухосновную кислоту.
136. Среди предложенных формул кислот: H3PO4, HClO4, H2SO4, HNO3 укажите
двухосновную кислоту.
137. Среди предложенных веществ: H2SiO3, H2S, HBr, H3BO3 укажите трехосновную
кислоту.
138. Среди предложенных формул: HF, HCl, H2SO4, HNO3, укажите
кислородсодержащую двухосновную кислоту.
139. Среди предложенных формул: H2SO3, H2SiO3, HNO3, HBr, укажите
кислородсодержащую одноосновную кислоту.
140. Среди предложенных формул кислот: HCl, H2SiO3, HРO3, H2SO3, укажите
одноосновную кислородсодержащую кислоту.
141. Среди предложенных формул кислот: HCl, H2SO3, H2SO4, HNO3, укажите
одноосновную кислородсодержащую кислоту.
142. Среди предложенных формул: H2CO3, H3PO4, HNO3, H2SiO3, укажите
кислородсодержащую одноосновную кислоту.
143. Среди предложенных формул: HPO3, HBr, H2SO3, H2CO3, укажите
бескислородную кислоту.
144. Среди предложенных формул: H2SO4, H2S, HBr, HPO3 определите двухосновную
бескислородную кислоту.
145. Среди предложенных веществ: H2SO4, H2SO3, H2S, H2SiO3, укажите
нерастворимую кислоту.
146. Среди предложенных веществ: H2SO4, H2SO3, Н3РО4, H2SiO3 укажите
нерастворимую в воде кислоту.
147. Среди предложенных формул: HCl, HNO2, H3PO4, HBr, укажите кислоту,
которая может образовывать кислые соли.
148. Среди предложенных формул: HNO3, H2SO4, HCl, HI, укажите кислоту, которая
может образовывать кислые соли.
149. Среди предложенных формул солей: (СuOH)2CO3, Na2CO3, NaHCO3, (NH4)2CO3,
укажите формулу кислой соли.
150. Среди предложенных формул: NaNO3, CuSO4, KРO3, NaHСO3, укажите кислую
соль.
151. Среди предложенных формул: NaOH, BaSO4, Cu(OH)Cl, KHСO3, укажите
кислую соль.
152. Среди предложенных формул: NaNO3, CuSO4, K3PO4, NaHSO4, определите
кислую соль.
153. Среди предложенных формул: Mg(OH)Cl, Na2HPO4, Al2(SO4)3, KH2PO4, укажите
среднюю соль.
154. Среди предложенных формул: Zn(OH)Cl, NaOH, Fe2(SO4)3, KH2PO4, укажите
среднюю соль.
155. Среди предложенных формул: AlCl3, Mg(OH)Cl, Na2HPO4, KH2PO4, выберите
среднюю соль.
156. Среди предложенных формул: Fe2(SO4)3, Mg(NO3)2, Mg(OH)Cl, NaHCO3,
укажите основную соль.
157. Среди предложенных формул: Cu(OH)Cl, Fe2(SO4)3, Cu(NO3)2, Na2CO3, укажите
основную соль.
158. Среди предложенных формул: Fe(OH)3, Zn(NO3)2, Cu(OH)Cl, KHCO3, укажите
основную соль.
159. Среди предложенных формул: K2CO3, BaSO4, AgNO3, MgCl2, укажите
нерастворимую соль.
160. Среди предложенных формул: Na2CO3, AgF, CaCl2, Mg3(PO4)2, укажите
нерастворимую соль.
161. Среди предложенных формул: NaCl, AgNO3, BaSO4, Mg(NO3)2, определите
нерастворимую соль.
162. Укажите заряды катионов и анионов, образующихся в водном растворе
карбоната калия.
163. Укажите заряды катионов и анионов, образующихся в водном растворе хлорида
калия.
164. Укажите заряды катионов и анионов, образующихся в водном растворе сульфата
натрия.
165. Вычислите и укажите в ответе заряд карбонат-иона в формуле гидрокарбоната
калия.
166. Вычислите и укажите в ответе заряд сульфат-иона в формуле гидросульфата
натрия.
167. Напишите уравнение диссоциации нитрата магния в водном растворе.
168. Укажите, при диссоциации какого из предложенных веществ: C6H5NO2,
Zn(NO3)2, NO2, Mg(NO2)2, образуются нитрат-ионы.
169. Укажите вещества, которые обуславливают временную жесткость воды.
170. Укажите два вещества, которые обуславливают временную жесткость воды.
171. Укажите вид химической связи, образованной атомами с небольшой разницей в
электроотрицательности.
172. Укажите тип связи, которая образуется между атомами с большой разницей в
электроотрицательности.
173. Укажите вид химической связи между атомами хлора и калия.
174. Укажите тип химической связи между атомами серы и кислорода.
175. Укажите вид химической связи между атомами серы и водорода.
176. Определите среди веществ: CO, NF3, H2S, KCl, соединение с ионной связью.
177. Определите среди веществ: CO2, NF3, H2S, NaCl, соединение с ионной связью.
178. Определите среди веществ: O2, NF3, PH3, LiCl, соединение с ионной связью.
179. Определите, в каком из соединений: NO2, N2, P4, CaBr2, существует ионная
связь.
180. Какая из предложенных молекул: Н2, N2, F2, О2 имеет наиболее прочную
химическую связь в молекуле?
181. Какая из предложенных молекул: Cl2, N2, Br2, О2 имеет наиболее прочную
химическую связь в молекуле?
182. Среди предложенных: HCl, CH4, N2, F2, выберите формулу вещества с
наибольшим количеством ковалентных связей.
183. Среди предложенных: HI, N2, CH4, O2, выберите формулу вещества с
наибольшим количеством ковалентных связей.
184. Чему равно число ковалентных связей, которое может образовать
невозбужденный атом серы за счет неспаренных электронов?
185. Чему равно число ковалентных связей, которое может образовать
невозбужденный атом хлора за счет неспаренных электронов?
186. Укажите тип орбиталей атомов водорода и хлора соответственно, которые
перекрываются в процессе образования молекулы HCl.
187. Укажите тип орбиталей атомов хлора, которые перекрываются в процессе
образования молекулы Cl2.
188. Укажите тип орбиталей атомов фтора, которые перекрываются в процессе
образования молекулы F2.
189. Укажите тип орбиталей атомов брома, которые перекрываются в процессе
образования молекулы Br2.
190. Укажите орбитали, на которых размещаются электроны в атоме кислорода.
191. Определите число общих электронных пар между атомами водорода в молекуле
Н2.
192. Определите число общих электронных пар между атомами азота в молекуле N2.
193. Определите число общих электронных пар между атомами фтора в молекуле F2.
194. Определите число общих электронных пар между атомами хлора в молекуле Cl2.
195. Укажите, в каком из соединений: BaO, HBr, K2O, NaCl, химическая связь между
атомами образована за счет общей электронной пары.
196. Укажите, в каком из соединений: HCl, BaO, Na2O, FeCl3, химическая связь
между атомами образована за счет общей электронной пары.
197. Укажите, в каком из соединений: LiCl, H2O, K2O, NaBr, химическая связь между
атомами образована за счет общей электронной пары.
198. Из предложенных: H2S, Cl2, CH4, HCl, укажите вещество, в котором химическая
связь наиболее полярная.
199. Из предложенных: H2S, Cl2, Na2O, HCl, укажите вещество, в котором химическая
связь наименее полярная.
200. Из предложенных HCl, HF, HI, HBr, укажите вещество, в котором химическая
связь наиболее полярная.
201. Из предложенных HCl, HF, HI, HBr, укажите вещество, в котором химическая
связь наименее полярная.
202. Из предложенных: H2O, H2, NH3, HCl, укажите вещество, в котором химическая
связь наименее полярная.
203. Среди предложенных веществ: CaO, NaCl, N2, CO2, укажите вещество с
ковалентной неполярной связью.
204. Среди предложенных веществ: Na2O, KCl, O2, SO2, укажите вещество с
ковалентной неполярной связью.
205. Среди веществ: CaO, NaCl, N2, H2S укажите вещество с ковалентной полярной
связью.
206. Среди веществ: CaCl2, KBr, N2, H2O укажите вещество с ковалентной полярной
связью.
207. Среди предложенных веществ: этан, фторид натрия, оксид углерода (II), этанол,
укажите вещество, между молекулами которого существует водородная связь.
208. Какую химическую связь образует в соединении с водородом химический
элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2?
209. Укажите тип кристаллической решетки в бинарном соединении химических
элементов с протонными числами 11 и 8.
210. Укажите тип кристаллической решетки в бинарном соединении химических
элементов с протонными числами 9 и 19.
211. Укажите тип кристаллической решетки для веществ, которые являются одними
из самых твердых.
212. Из предложенных веществ: лед, алмаз, иод, поваренная соль, укажите вещество,
которое в твердом состоянии имеет атомную кристаллическую решетку.
213. Из предложенных веществ: лед, кремний, поваренная соль, крахмал, укажите
вещество, которое в твердом состоянии имеет атомную кристаллическую решетку.
214. Укажите, какое из соединений: хлорид цинка, оксид железа (ΙΙΙ), оксид серы (ΙV),
бромид калия, является веществом молекулярного строения.
215. Укажите в какой из молекул: аммиак, ацетилен, этилен, хлороводород, есть две
-связи.
216. Выберите из предложенного перечня: этанол, этен, пропан, этин и напишите в
бланк ответов молекулярную формулу вещества, в молекуле которого присутствуют две
-
связи.
217. Укажите число σ-связей в молекуле этана.
218. Укажите тип гибридизации атомов углерода в молекулах насыщенных
углеводородов.
219. Укажите тип гибридизации атомов углерода в молекулах алканов.
220. Укажите угол связи между атомами углерода в молекулах насыщенных
углеводородов.
221. Укажите число химических элементов и число атомов в составе соединения,
формула которого CH3COOH.
222. Напишите название фракции, которая выделяется при перегонке нефти и
содержит углеводороды от С5Н12 до С11Н24.
223. Укажите из предложенного перечня: спирты, углеводы, жиры, углеводороды,
главную составляющую нефти.
224. Укажите значение, которое соответствует углу между гибридными
электронными орбиталями атомов углерода в молекуле этена.
225. Укажите пространственное строение молекулы, которое характерно для первого
члена гомологического ряда предельных углеводородов.
226. Укажите пространственное строение молекулы, которое соответствует
sp-гибридизации атомных орбиталей.
227. Укажите количество ковалентных связей между атомами углерода в молекуле
бутана.
228. Укажите мономер, который полимеризуется с образованием соединения,
формула которого [−CH2−CH(CH3)−]n.
229. Укажите мономер, который полимеризуется с образованием соединения,
формула которого (−CH2−CH2−)n.
230. Напишите молекулярную формулу алкана, молекула которого содержит шесть
атомов углерода.
231. Напишите молекулярную формулу алкена, молекула которого содержит семь
атомов углерода.
232. Напишите молекулярную формулу алкена, молекула которого содержит пять
атомов углерода.
233. Напишите молекулярную формулу алкена, молекула которого содержит шесть
атомов углерода.
234. Составьте молекулярную формулу алкадиена, содержащего шесть атомов
углерода.
235. Составьте молекулярную формулу алкадиена, содержащего пять атомов
углерода.
236. Составьте молекулярную формулу алкадиена, содержащего четыре атома
углерода.

237. Напишите молекулярную формулу алкина, молекула которого содержит пять
атомов углерода.
238. Напишите молекулярную формулу алкина, молекула которого содержит шесть
атомов углерода.
239. Напишите молекулярную формулу диметиламина.
240. Напишите молекулярную формулу одноосновной карбоновой
кислоты,
молекула которой содержит два атома углерода.
241. Напишите молекулярную формулу одноосновной карбоновой
кислоты,
молекула которой содержит один атом углерода.
242.
Напишите молекулярную формулу пальмитиновой кислоты.
243.
Напишите молекулярную формулу стеариновой кислоты.
244.
Напишите формулу метиламина.
245.
Составьте структурную формулу 2-метилбутаналя.
246.
Составьте структурную формулу 3,4-диметилгексена-1.
247.
Составьте структурную формулу молекулы 3,3-диметилпентена-1.
248.
Составьте структурную формулу молекулы 2,3-диметилпентена-2.
249.
Составьте структурную формулу 3,4-диметилпентена-1.
250.
Составьте структурную формулу 2-метилпропаналя.
251.
Составьте структурную формулу 2-метилпентанола-1.
252.
Составьте структурную формулу молекулы 2-метилбутадиена-1,3.
253.
Составьте структурную формулу молекулы 3,4-диметилпентанола-2.
254.
Составьте структурную формулу 2,2-диметилбутаналя.
255.
Составьте структурную формулу 2,3-диметилпентана.
256.
Составьте структурную формулу 2-метилбутанола-1.
257.
Изобразите структурную формулу 3-метил-4-этилгексина-1.
258.
Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
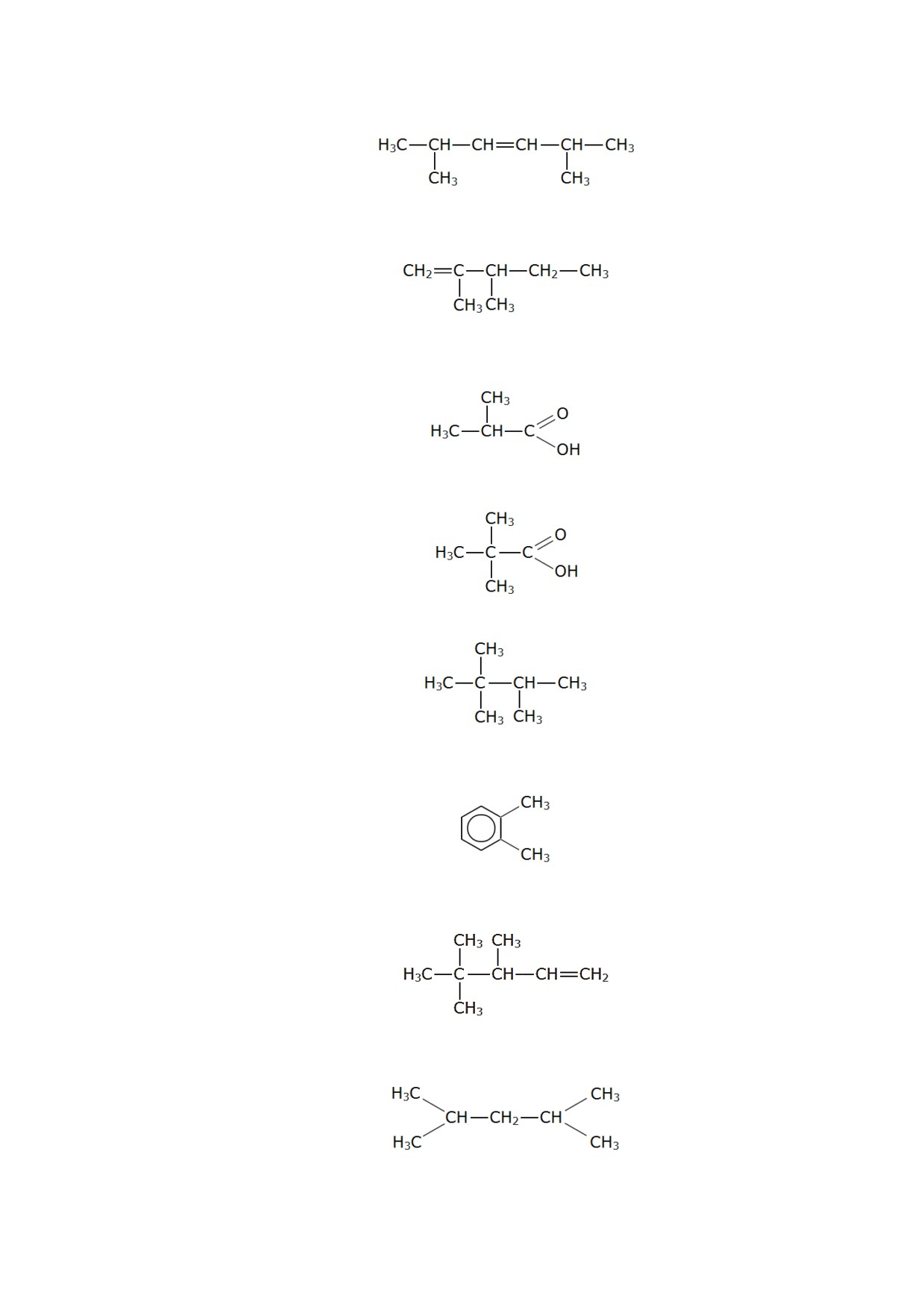
259. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
260. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
261. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
262. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
263. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
264. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
265. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
266. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
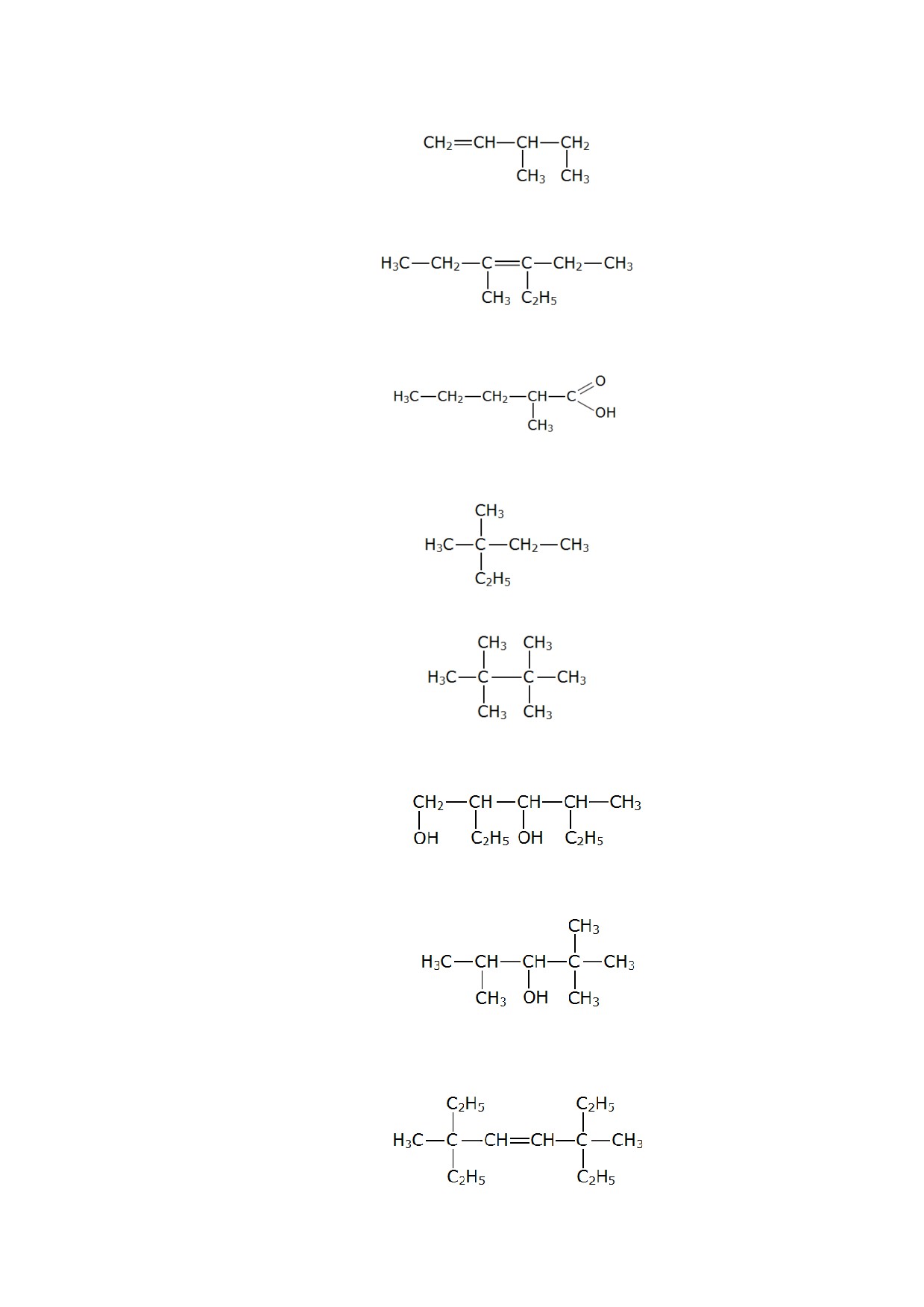
267. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
268. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
269. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
270. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
271. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
272. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
273. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
274. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:

275. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
276. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
277. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
278. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
279. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
280. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
281. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
282. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
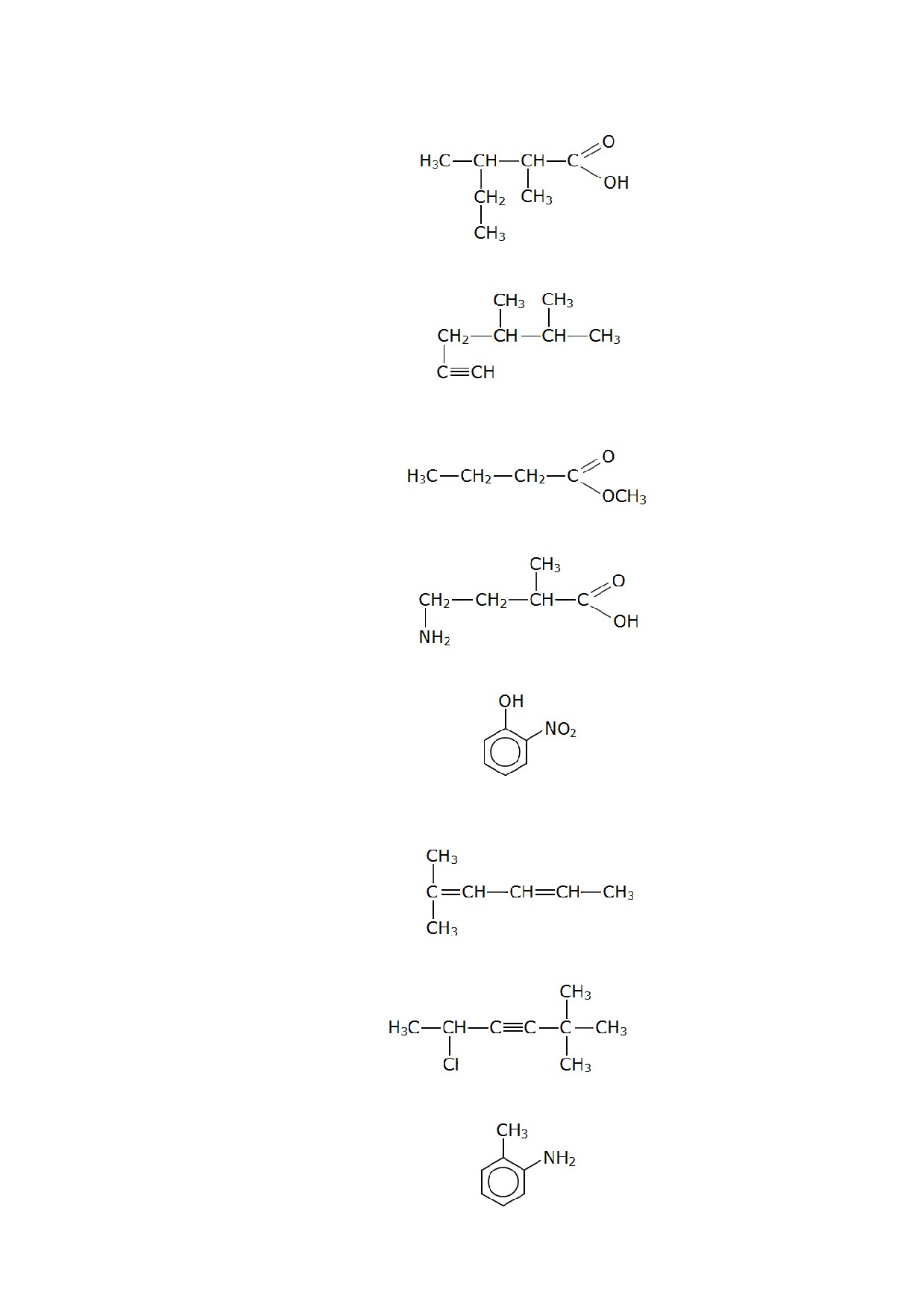
283. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
284. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
285. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
286. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
287. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
288. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
289. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
290. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:

291. Назовите по систематической номенклатуре вещество, имеющее структурную
формулу:
292. Укажите молекулярную формулу вещества, при гидролизе которого образуется
глюкоза и фруктоза.
293. Укажите молекулярную формулу седьмого члена гомологического ряда алканов.
294. Укажите молекулярную формулу восьмого члена гомологического ряда алканов.
295. Укажите вещество, которое образуется в результате тримеризации ацетилена.
296. Укажите общую формулу членов гомологического ряда,
к которому
принадлежит пентан.
297. Напишите общую формулу членов гомологического ряда,
к которому
принадлежит бутен-1.
298. Напишите общую формулу гомологического ряда, к которому
принадлежит
бутин-1.
299. Укажите общую формулу гомологического ряда, к которому
принадлежит
C2H5OH.
300. Укажите общую формулу членов гомологического ряда,
к которому
принадлежит октан.
301. Укажите общую формулу членов гомологического ряда,
к которому
принадлежит C10H22.
302. Укажите общую формулу гомологического ряда, к которому
принадлежит
CH3OH.
303. Напишите общую формулу гомологического ряда, к которому
принадлежит
пентин-1.
304. Укажите общую формулу гомологического ряда, к которому
принадлежит
бутадиен-1,3.
305. Среди предложенных формул: С2Н4, С3Н8, С3Н4, С6Н6 укажите гомолог этина.
306. Напишите названия веществ - продуктов гидролиза сахарозы.
307. Укажите, к какому классу углеводородов относится соединение с формулой
C2H2.
308. К какому классу углеводородов относится соединение с формулой C6H6?
309. Укажите класс органических соединений, к которым принадлежит метанол.
310. Укажите, к какому классу органических соединений относится (СН3)3N.
311. Укажите, к какому классу органических соединений относится анилин.
312. Укажите, к какому классу органических соединений относится вещество,
которое образуется в результате присоединения воды к ацетилену в присутствии солей
ртути.
313. Укажите, к какому классу органических соединений относится глицерин.
314. Укажите, к какому классу органических соединений относится бензол.
315. Укажите, к какому классу органических соединений относится вещество,
которое образуется в результате тримеризации ацетилена.
316. К какому классу непредельных углеводородов относится соединение с
формулой СН2=СН−СН3?
317. Укажите, к какому классу непредельных углеводородов относится соединение с
формулой C2H2.
318. Укажите функциональную группу, которая является носителем основных
свойств аминокислот.
319. Напишите формулу радикала пропила.
320. Запишите название вещества, которое является основным составляющей
природного газа.
321. Выберите и напишите в ответе уравнение реакции соединения:
CaCO3 = CaO + CO2
NaCl + H2SO4 = NaНSO4 + HCl
Zn(OH)2 = ZnO + H2O
H2 + Cl2 = 2HCl
322. Выберите и напишите в ответе уравнение реакции соединения:
MgCO3 = MgO + CO2
H2 + Cl2 = 2HCl
NaCl + H2SO4 = NaНSO4 + HCl
Fe(OH)2 = FeO + H2O
323. Определите и напишите в ответе уравнение реакции соединения, в результате
которой образуется нерастворимое вещество:
S + O2 = SO2
CO2 + CaO = CaCO3
P2O5 + 3H2O = 2H3PO4
4P + 5O2 = 2P2O5
324. Определите и напишите в ответе уравнение реакции разложения:
2NaOH + CO2 = Na2CO3 + H2O
2KClO3 = 2KCl + 3O2
CuSO4 + Fe = FeSO4 + Cu
Na2O + H2O = 2NaOH
325. Определите и напишите в ответе уравнение реакции разложения:
2NaOH + CO2 = Na2CO3 + H2O
2KClO3 = 2KCl + 3O2
MgO + SO2 = MgSO3
Na2O + H2O = 2NaOH
326. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуется газообразное вещество:
Zn + 2HCl = ZnCl2 + H2
2NaCl + H2SO4 = Na2SO4 + 2HCl
2KClO3 = 2KCl + 3O2
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
327. Запишите в ответе уравнение реакции разложения, в результате
которой
образуются и простые и сложные вещества:
2Fe(OH)3 = Fe2O3 + 3H2O
2KMnO4 = K2MnO4 + MnO2 + O2
CH4 + 2O2 = CO2 + 2H2O
BaSiO3 = SiO2 + BaO
328. Определите и напишите в ответе уравнение реакции разложения:
2NaOH +H2 SO4 = Na2SO4 +2H2O
K2O + H2O = 2KOH
CuSO4 + Fe = FeSO4 + Cu
2KClO3 = 2KCl + 3O2
329. Запишите в ответе уравнение реакции разложения, в результате
которой
образуются и простые и сложные вещества:
2Al(OH)3 = Al2O3 + 3H2O
CH4 + 2O2 = CO2 + 2H2O
2NaNO3 = 2NaNO2 + O2
СuSO4 + Fe = FeSO4 + Cu
330. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуются только простые вещества:
2KClO3 = 2KCl + 3O2
2HgO = 2Hg + O2
2Сu(NO3)2 = 2CuO + 4NO2 + O2
2H2O2 = 2H2O + O2
331. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуются только простые вещества:
2H2O = 2H2
+ O2
2KClO3 = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
CaCO3 = CaO + CO2
332. Определите и напишите в ответе уравнение реакции замещения:
4HNO3 = 2H2O + 4NO2 + O2
KOH + HCl = KCl + H2O
2Na + 2H2O = 2NaOH + H2
NaCl + AgNO3 = AgCl
+ NaNO3
333. Определите и напишите в ответе уравнение реакции замещения:
2Fe + 3Cl2= 2FeCl3
2Al + 6HCl = 2AlCl3 + 3H2
Na2O + SO3 = Na2SO4
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2
334. Определите и напишите в ответе уравнение реакции замещения:
4HNO3 = 2H2O + 4NO2 + O2
NaOH + HCl = NaCl + H2O
2K + 2H2O = 2KOH + H2
KCl + AgNO3 = KNO3+ AgCl
335. Определите и напишите в ответе уравнение реакции замещения, в результате
которой выделяется газообразное вещество:
2Al + 6HCl = 2AlCl3 + 3H2
2HCl + Na2SO3 = 2NaCl + H2O + CO2
Zn + CuCl2 = Cu + ZnCl2
MgO + CO2 = MgCO3
336. Определите и напишите в ответе уравнение реакции замещения, в результате
которой образуется газообразное вещество:
СuSO4 + Fe = FeSO4 + Cu
2NaCl + H2SO4 = Na2SO4 + 2HCl
2KClO3 = 2KCl + 3O2
Zn + 2HCl = ZnCl2 + H2
337. Определите и напишите в ответе уравнение реакции обмена:
2NaCl + F2 = 2NaF + Cl2
NaOH + HNO3 = NaNO3 + H2O
2K + S = K2S
2Na + Cl2 = 2NaCl
338. Определите и напишите в ответе уравнение реакции обмена:
2NaВr + Сl2 = 2NaCl + Br2
2Al + 3S = Al2S3
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
2Na + Cl2 = 2NaCl
339. Определите и напишите в ответе уравнение реакции обмена:
Fe + S = FeS
2Al + 6HCl = 2AlCl3 + 3H2
Na2O + CO2 = Na2CO3
2NaOH + CuCl2 = 2NaCl + Cu(OH)2
340. Определите и напишите в ответе уравнение реакции
обмена,
в
результате
которой образуется осадок:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
2NaOH + H2SO4 = Na2SO4 + H2O
2NaNO3 =2NaNO2 +O2
341. Определите и напишите в ответе уравнение реакции
обмена,
в
результате
которой образуется осадок:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
2KMnO4 = K2MnO4 + MnO2 + O2
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
2NaOH + H2SO4 = Na2SO4 + H2O
342. Определите и напишите в ответе уравнение реакции
обмена,
в
результате
которой образуется осадок.
K2SO3 + 2HCl = 2KCl + SO2 + H2O
NaCl + AgNO3 = AgCl + NaNO3
NaOH + HNO3 = NaNO3 + H2O
2NaNO3 = 2NaNO2 + O2
343. Определите и напишите в ответе уравнение реакции
обмена,
в
результате
которой образуется нерастворимое вещество:
Na2O + 2HCl = 2NaCl + H2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2
SO2 + H2O = H2SO3
HCl + AgNO3 = AgCl + HNO3
344. Определите и напишите в ответе уравнение реакции
обмена,
в
результате
которой образуется нерастворимое вещество:
NaOH + HCl = NaCl + H2O
SO2 + H2O = H2SO3
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
2HCl + Na2CO3 = 2NaCl + H2O + CO2
345. Определите и напишите в ответе уравнение окислительно-восстановительной
реакции:
SO3 + H2O = H2SO4
S + 2HNO3 (РАЗБ.) = H2SO4 + 2NO
2NaOH + H2SO4 = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
346. Определите и запишите в ответе реакцию, которая является окислительно-
восстановительной:
CaO + SO2 = CaSO3
Cu(OH)2 = CuO + H2O
S + O2 = SO2
H2SO4 + BaCl2 = BaSO4
+ 2HCl
347. Определите и запишите в ответе реакцию, которая является окислительно-
восстановительной:
Li2O + H2O = 2LiOH
BaCl2 + CuSO4 = BaSO4
+ CuCl2
C + O2 = CO2
AgNO3 + KBr = AgBr
+ KNO3
348. Определите и напишите в ответе уравнение, которое одновременно является и
реакцией разложения и окислительно-восстановительной реакцией:
2Al(OH)3 = Al2O3 + 3H2O
2SO2 + O2 = 2SO3
2KClO3 = 2KCl + 3O2
349. Определите и запишите в ответе реакцию, которая является окислительно-
восстановительной:
Na2O + H2O = 2NaOH
BaCl2 + K2SO4 = BaSO4
+ 2KCl
S + O2 = SO2
AgNO3 + KBr = AgBr
+ KNO3
350. Определите и запишите в ответе реакцию, которая является окислительно-
восстановительной:
CaO+2HCl =CaCl2 +H2O
Fe(OH)2 = FeO + H2O
CH4 +2O2 =CO2 +2H2O
Na2SO4 + BaCl2 = BaSO4
+ 2NaCl
351. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
2H2 + O2 = 2H2O
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
352. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
Fe2O3 + 3CO = 2Fe + 3CO2
P2O5 + 5C = 5CO + 2P
CuO + CO = Cu + CO2
BaO + CO2 = BaCO3
353. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
Fe2O3 + 3CO = 2Fe + 3CO2
2H2S + O2 = 2S +2H2O
CuO + H2 = Cu + H2O
Na2O + CO2 = Na2CO3
354. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
S + O2 = SO2
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Mg + 2HCl = MgCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
355.
Определите и напишите в ответе уравнение некаталитической реакции:
N2 + 3H2 Fe
2NН3
MnO
2
2H2O2
2H2O + O2
KOH + HCl = KCl + H2O
С6Н12О6 ферменты
2C2H5OH + 2СО2
356.
Определите и напишите в ответе уравнение некаталитической реакции:
N2 + 3H2 Fe
2NН3
MnO
2
2H2O2
2H2O + O2
hν
СН4 + Cl2
СН3Cl + HCl
С6Н12О6 ферменты
2C2H5OH + 2СО2
357.
Определите и напишите в ответе уравнение эндотермической реакции:
N2 + 3Н2 = 2NН3 + Q
CaCO3 = CaO + CO2 - Q
358.
Определите и напишите в ответе уравнение эндотермической реакции:
СaO + 3C = CaC2 + CO - Q
C4H8 + H2 = C4H10 + Q
359.
Определите и напишите в ответе уравнение эндотермической реакции:
N2 + 3Н2 = 2NН3 + Q
CaCO3 = CaO + CO2 - Q
360.
Определите и напишите в ответе уравнение экзотермической реакции:
СaO + 3C = CaC2 + CO - Q
C3H6 + H2 = C3H8 + Q
361.
Определите и напишите в ответе уравнение реакции, являющейся
экзотермической:
S+ O2= SO2 + Q
СаСО3 = СаО + СО2 - Q
362. Определите и напишите в ответе уравнение реакции, являющейся
экзотермической:
FeO + CO = Fe + CO2 + Q
СаСО3 = СаО + СО2 - Q
363. Определите вещество Х и запишите в ответе его название:
t°
2Fe(OH)3
X + 3H2O
364.
Определите вещество Х и запишите в ответе его название:
Al(OH)3 + 3HCl = X + 3H2O
365.
Определите вещество Х и запишите в ответе его название:
4NH3 + 5O2
4Х + 6H2O
366.
Определите вещество Х и запишите в ответе его название:
Cu + X CuSO4 + SO2 + H2O
367.
Определите вещество Х и запишите в ответе его название:
СаСО3 + 2HCl = CaCl2 + H2O + X
368.
Определите вещество Х и запишите в ответе его название:
СaC2 + 2H2O = C2H2 + X
369.
Определите вещество Х и напишите в ответе его систематическое название:
Al4C3 + 12H2O = 4Al(OH)3 + 3X
370.
Определите вещество Х и запишите в ответе его название:
1000°C
СН4
Х + 2Н2
371.
Определите вещество Х и запишите в ответе его систематическое название:
CH4 X C6H6
372.
Определите вещество Х и напишите в ответе его систематическое название:
2CН3Cl + 2Na
2NaCl + Х
373.
Определите вещество Х и запишите в ответе его название:
СН3−СН2−Br + NaOH(спиртовой раствор) Х + NaBr + Н2О
374.
Определите вещество Х и запишите в ответе его название:
CH3−CH2−Br + NaOH(водный раствор) NaBr + X
375.
Определите вещество Х и напишите в ответе его название:
+
H
СН2=СН2 + НОН
Х
376.
Определите вещество Х и запишите в ответе его название:
СН2=СН−СН3 + НСl Х
377.
Определите вещество Х и запишите в ответе его систематическое название:
+
H
СН2=СН−СН3 + НОН
Х
378.
Определите вещество Х и запишите в ответе его название:
НС≡СН + 2Н2 Х
379.
Определите вещество Х в схеме превращений и напишите в ответе
его
систематическое название:
С2Н2 Х СН3СООН
380. Определите вещество Х и запишите в ответе его название по систематической
номенклатуре:
2+
Hg
HC≡CH + H2O
X
381. Определите вещество Х и запишите в ответе его название, если известно, что
исходные вещества взаимодействуют в соотношении 1:1:
СН≡С−СН3 + HBr X
382. Определите вещество Х и запишите в ответе его название:
600°С, Сакт
3СН≡СН
Х
383. Определите вещество Х и запишите в ответе его систематическое название:
C6H6 + Cl2 h
X
384. Определите вещество Х в схеме превращений и напишите в ответе его
систематическое название:
C6H5Cl X C6H5COOH
385. Определите вещество Х и запишите в ответе его название:
СН3СНО + Н2 Х
386. Определите вещество Х и запишите в ответе его название:
>140°C
С2Н5ОН
Х + Н2О
387. Определите вещество Х и запишите в ответе его название по систематической
номенклатуре:
2
4
C6H5OH + 3HO−NO2
3H2O + X
388. Определите вещество Х и запишите в ответе его систематическое название:
Х + CuO CH3CHO + Cu + H2O
389. Определите вещество Х и запишите в ответе его название:
СН3СООNa + NaOH Na2CO3 + X
390. Определите вещество Х и запишите в ответе его название:
С6Н12О6 ферменты Х + 2СО2
391. Установите вещество Х и запишите в ответе его систематическое название.
С2Н5СООNa + NaOH t° X + Na2CO3
392. Вычислите молярную массу Na[Al(OH)4].
393. Вычислите молярную массу глюкозы.
394. Вычислите молярную массу сахарозы.
395. Рассчитайте молярную массу этиленгликоля.
396. Вычислите молярную массу этанола.
397. Вычислите молярную массу кристаллогидрата CuSO4 5Н2O.
398. Вычислите молярную массу кристаллогидрата FeSO4 7Н2O?
399. Масса некоторого соединения, взятого количеством вещества 0,002 моль, равна
128 мг. Рассчитайте молярную массу этого вещества.
400.
Определите массу 0,5 моль CuSO4∙5H2O.
401.
Вычислите массу Na[Al(OH)4] количеством вещества 1 моль.
402.
Вычислите массу K[Al(OH)4] количеством вещества 2 моль.
403.
Вычислите массу кислорода в SO2 количеством вещества 0,5 моль.
404.
Вычислите массу SO2 количеством вещества 0,25 моль.
405.
Определите массу 0,4 моль Mg3N2.
406.
Определите массу 5 моль Zn3N2.
407.
Определите массу 5 моль Zn3(РО4)2.
408.
Вычислите массу 1 моль кристаллогидрата CuSO4∙5Н2O.
409.
Вычислите массу 18,06∙1023 атомов натрия.
410.
Вычислите массу 12,04∙1023 атомов кальция.
411.
Вычислите массу 1,204∙1023 атомов магния.
412.
Сколько моль сульфида железа (II) содержится в 17,6 г FeS?
413.
Сколько моль сульфида железа (II) содержится в 8,8 г FeS?
414.
Определите количество вещества сульфата калия массой 87 г.
415.
Определите количество вещества фосфата натрия массой 82 г.
416.
Определите количество молекул воды, содержащхся в 72 г воды.
417.
Определите количество молекул воды, содержащхся в 36 г воды.
418.
Вычислите, сколько молекул содержится в 3,4 г аммиака.
419.
Вычислите, сколько молекул содержится в 0,85 г аммиака.
420.
Определите число атомов водорода в сернистой кислоте количеством вещества
20 моль.
421. Определите число атомов водорода в сернистой кислоте количеством вещества
10 моль.
422. Определите число атомов водорода в сернистой кислоте количеством вещества
20 моль.
423. Определите число атомов кислорода в озоне количеством вещества 0,3 моль.
424. Определите число атомов кислорода в озоне количеством вещества 0,5 моль.
425. Определите число атомов водорода в сероводороде количеством вещества
2 моль.
426. Определите число атомов водорода в сероводороде количеством вещества
5 моль.
427. Определите число атомов водорода в сероводороде количеством вещества
2 моль.
428. Определите число атомов водорода в гидроксиде кальция количеством вещества
5 моль.
429. Определите количество атомов кислорода в гидроксиде кальция количеством
вещества 10 моль.
430. Определите объем 18,06∙1023 молекул водорода (при н.у.).
431. Определите объем 12,04∙1023 молекул водорода (при н.у.)
432. Определите объем 18,06∙1023 молекул водорода (при н.у.).
433. Определите объем 0,3 моль углекислого газа при н.у.
434. Определите объем 4 моль аммиака при н.у.
435. Определите объем 3 моль аммиака при н.у.
436. Вычислите объем углекислого газа (н.у.) количеством вещества 0,3 моль.
437. Вычислите объем углекислого газа (н.у.) количеством вещества 4 моль.
438. Вычислите количество вещества сернистого газа объемом 4,48 л (н.у.)
439. Укажите, во сколько раз масса 2,75 моль сернистого газа больше, чем масса
2 моль углекислого газа.
440. Плотность некоторого газа по воздуху равна
2. Определите, чему равна
плотность этого газа по водороду.
441. Сделайте необходимые вычисления и укажите относительную молекулярную
массу некоторого газа, относительная плотность которого по кислороду 1,5.
442. Составьте уравнение химической реакции между оксидом лития и водой. В
ответе укажите коэффициент возле формулы продукта реакции.
443. Составьте уравнение химической реакции между соляной кислотой и оксидом
алюминия с образованием средней соли. В ответе укажите сумму всех коэффициентов.
444. Составьте уравнение химической реакции между соляной кислотой и
гидроксидом алюминия. В ответе укажите сумму всех коэффициентов.
445. Составьте уравнение химической реакции каталитического окисления оксида
серы (IV). В ответе укажите сумму всех коэффициентов.
446. Составьте уравнение химической реакции между соляной кислотой и магнием. В
ответе укажите сумму всех коэффициентов.
447. Составьте уравнение химической реакции между соляной кислотой и магнием. В
ответе укажите коэффициент перед формулой соляной кислоты.
448. Составьте уравнение химической реакции между оксидом магния и
ортофосфорной кислотой с образованием средней соли. В ответе укажите сумму всех
коэффициентов.
449. Составьте уравнение химической реакции между кислородом и кальцием. В
ответе укажите сумму всех коэффициентов.
450. Составьте уравнение химической реакции между кислородом и кальцием. В
ответе укажите коэффициент возле формулы продукта реакции.
451. Составьте уравнение химической реакции между кислородом и угарным газом.
В ответе укажите коэффициент возле формулы продукта реакции.
452. Составьте уравнение химической реакции между кислородом и угарным газом.
В ответе укажите сумму всех коэффициентов.
453. Составьте уравнение химической реакции между кислородом и магнием.
В ответе укажите сумму всех коэффициентов.
454. Составьте уравнение химической реакции между кислородом
(взятым в
избытке) и фосфором. В ответе укажите сумму всех коэффициентов.
455. Составьте уравнение химической реакции между кислородом (в избытке) и
фосфором. В ответе укажите коэффициент возле формулы кислорода.
456. Составьте уравнение химической реакции между кислородом и магнием.
В ответе укажите коэффициент возле формулы продукта реакции.
457. Составьте уравнение химической реакции взаимодействия воды и натрия.
В ответе укажите коэффициент, стоящий перед формулой газообразного продукта реакции.
458. Составьте уравнение химической реакции горения этина. В ответе укажите
коэффициент перед формулой кислорода.
459. Составьте уравнение химической реакции между кислородом и серой. В ответе
укажите коэффициент возле формулы кислорода.
460. Составьте уравнение химической реакции между кислородом и алюминием.
В ответе укажите коэффициент возле формулы кислорода.
461. Составьте уравнение химической реакции между кислородом и алюминием.
В ответе укажите коэффициент возле формулы продукта реакции.
462. Составьте уравнение химической реакции между кислородом и углеродом при
недостатке кислорода. В ответе укажите коэффициент возле формулы продукта реакции.
463. Составьте уравнение химической реакции между нитратом серебра и хлоридом
натрия. В ответе укажите коэффициент возле формулы осадка.
464. Составьте уравнение химической реакции между оксидом углерода (IV) и
избытком гидроксида бария. В ответе укажите сумму всех коэффициентов.
465. Составьте уравнение химической реакции горения пропана. В ответе укажите
коэффициент перед формулой кислорода.
466. Составьте уравнение химической реакции между оксидом серы (VΙ) и
гидроксидом натрия. В ответе укажите коэффициент возле формулы щелочи, учитывая, что
одним из продуктов реакции является средняя соль.
467. Составьте уравнение химической реакции между цинком и соляной кислотой.
В ответе укажите коэффициент возле формулы соли.
468. Составьте уравнение химической реакции разложения нитрата натрия. В ответе
укажите коэффициент возле формулы газообразного продукта реакции.
469. Составьте уравнение химической реакции разложения нитрата калия. В ответе
укажите коэффициент возле формулы газообразного продукта реакции.
470. Составьте уравнение химической реакции термического разложения нитрата
серебра. В ответе укажите коэффициент возле формулы твердого продукта реакции.
471. Составьте уравнение химической реакции термического разложения нитрата
меди. В ответе укажите коэффициент возле формулы твердого продукта реакции.
472. Составьте уравнение химической реакции разложения гидроксида алюминия.
В ответе укажите коэффициент возле формулы реагента.
473. Составьте уравнение химической реакции между кислородом и сернистым
газом. В ответе укажите коэффициент возле формулы продукта реакции.
474. Составьте уравнение химической реакции горения метана. В ответе укажите
коэффициент возле формулы кислорода.
475. Составьте уравнение химической реакции между этеном и хлором. В ответе
укажите коэффициент перед формулой хлора.
476. Составьте уравнение химической реакции между этином и водородом, в
результате которой образуется гомолог метана. В ответе укажите коэффициент перед
формулой водорода.
477. Составьте уравнение химической реакции полного окисления этана. В ответе
укажите коэффициент перед формулой кислорода.
478. Составьте уравнение химической реакции между этином и хлором, в результате
которой образуется хлорпроизводное алкана. В ответе укажите коэффициент перед
формулой хлора.
479. Укажите соотношение между количествами веществ бензола и водорода в
уравнении химической реакции, продуктом которой является циклогексан.
480. Укажите соотношение между количествами веществ бензола и хлора в
уравнении химической реакции, продуктом которой является гексахлорциклогексан.
481. Вычислите массовую долю кислорода (%) в соединении SO2.
482. Смесь массой
30 кг состоит из песка и почвы. Вычислите массу песка,
входящего в состав смеси, если известно, что массовая доля почвы в этой смеси равна 20%.
483. Смесь массой 50 кг состоит из песка и древесных опилок. Вычислите массу
песка, входящего в состав смеси, если известно, что массовая доля древесных опилок в этой
смеси равна 30%.
484. Определите массовую долю (%) углерода в метане.
485. Определите, в каком массовом отношении находятся натрий и кислород в
соединении, формула которого Na2O2.
486. Определите, в каком массовом отношении находятся медь и кислород в
соединении, формула которого CuO?
487. Определите, в каком массовом отношении находятся сера и кислород в
соединении, формула которого SO3.
488. Вычислите массовую долю (%) химического элемента азота в оксиде азота (V).
(Число, являющееся ответом задачи, округлить до целого по правилам математического
округления.)
489. Вычислите массовую долю
(%) химического элемента фосфора в оксиде
фосфора (V).
(Число, являющееся ответом задачи, округлить до целого по правилам
математического округления.)
490. Определите массовую долю гидроксида натрия, если его раствор массой 60 г
содержит гидроксид натрия массой 6 г.
491. Определите массовою долю гидроксида натрия, если его раствор массой 120 г
содержит гидроксид натрия массой 24 г.
492. Определите массовую долю (в %) гидроксида натрия, если его раствор массой
80 г содержит гидроксид натрия массой 16 г.
493. Определите массовою долю серной кислоты, если раствор массой
200 г
содержит кислоту массой 50 г.
494. Определите массовую долю соли в растворе, который образуется при
растворении в 180 мл воды 20 г кухонной соли, приняв плотность воды равной 1 г/мл.
495. Определите массовую долю (в %) соли в растворе, полученном растворением
24 г соли в воде массой 36 г.
496. В воде объёмом 350 мл растворили соль массой 50 г. Определите массовую
долю соли в полученном растворе, приняв плотность воды равной 1 г/мл.
497. В воде объёмом 200 мл растворили соль массой 50 г. Определите массовую
долю соли в полученном растворе, если плотность воды равна 1 г/мл.
498. В воде объёмом 150 мл растворили соль массой 50 г. Определите массовую
долю соли (%) в полученном растворе, приняв плотность воды равной 1 г/мл.
499. Какую массу ортофосфата калия и воды надо взять для приготовления раствора
массой 25 г с массовой долей соли 20%?
500. Какие массы сульфата натрия и воды надо взять для приготовления 400 г
раствора с массовой долей Na2SO4 10%?
501. Какова масса 3%-ного раствора карбоната калия, в котором содержится 1,38 г
соли?
502. Вычислить объем воды
(приняв плотность воды равной
1 г/мл), который
необходимо прилить к 15 г соли для того, чтобы получить 25%-ный раствор соли.
503. Вычислите объем воды
(приняв плотность воды равной
1 г/мл), который
необходимо прилить к 24 г соли для того, чтобы получить 6%-ный раствор.
504. Вычислите массы сульфата калия и воды, необходимых для приготовления
раствора массой 450 г с массовой долей K2SO4 6%?
505. Какие массы сульфата калия и воды надо взять для приготовления раствора
массой 48 г с массовой долей K2SO4 15%?
506. Какие массы сульфата натрия и воды надо взять для приготовления 400 г
раствора с массовой долей Na2SO4 10%?
507. Какую массу сульфата натрия и воды надо взять для приготовления раствора
массой 240 г с массовой долей Na2SO4 9%?
508. Какую массу ортофосфата калия и воды надо взять для приготовления раствора
массой 250 г с массовой долей соли 8%?
509. Какую массу соли и воды надо взять для приготовления 300 г раствора с
массовой долей NaCl 15%?
510. Какую массу соли и воды надо взять для приготовления раствора массой 300 г с
массовой долей NaCl 8%?
511. Какую массу соли и воды надо взять для приготовления раствора массой 350 г с
массовой долей NaCl 12%?
512. Какую массу соли и воды надо взять для приготовления раствора массой 120 г с
массовой долей NaCl 30%?
513. Какую массу соли и воды надо взять для приготовления раствора массой 150 г с
массовой долей NaCl 30%?
514. Вычислите, какую массу воды необходимо прилить к 25 г сахара для того, чтобы
получить 10%-ный раствор сахара.
515. Вычислите, какую массу воды необходимо прилить к 30 г сахара для того, чтобы
получить 20%-ный раствор сахара.
516. Вычислите массу соли, которую необходимо растворить в 50 г воды для того,
чтобы получить 20%-ный раствор соли.
517. Вычислите массу соли, которую необходимо растворить в 30 г воды для того,
чтобы получить 20%-ный раствор соли.
518. Вычислите массу соли, которую необходимо растворить в 27 г воды для того,
чтобы получить 10%-ный раствор соли.
519. Вычислите массу соли, которую необходимо растворить в 30 г воды для того,
чтобы получить 12,5%-ный раствор соли.
520. Вычислите массу NaOH, которую необходимо растворить в 120 мл воды для
того, чтобы получить 20%-ный раствор NaOH.
521. Определите массовую долю (в %) соли в растворе, полученном растворением
15 г соли в воде массой 45 г.
522. Определите массовою долю (в %) соли в растворе, если растворили 5 г соли в
воде массой 45 г.
523. Определите массовою долю соли в растворе, если в воде массой 85 г растворили
15 г соли.
524. Определите массу раствора, который образуется при растворении в 130 г воды
20 г кухонной соли.
525. Определите массу раствора, который образуется при растворении в 120 г воды
60 г кухонной соли.
526. Определите массу раствора, который образуется при растворении в 90 г воды
10 г кухонной соли.
527. Вычислите массу раствора, который образуется при растворении в 80 г воды 20 г
кухонной соли.
528. Вычислите массу раствора, который образуется при растворении в 170 г воды
40 г кухонной соли.
529. Установите соотношение масс элементов в соединении СО2.
530. Магний соединяется с серой в массовом соотношении 3:4. Укажите массы серы
и магния, необходимых для получения 140 г сульфида магния.
531. Магний соединяется с серой в массовом соотношении 3:4. Укажите массы серы
и магния, необходимых для получения 56 г сульфида магния.
532. Медь соединяется с серой в соотношении 4:1. Сколько потребуется по массе
исходных простых веществ для получения 20 г сульфида меди (II).
533. Кальций соединяется с серой в соотношении 5:4. Сколько потребуется по массе
исходных веществ для получения 90 г сульфида кальция.
534. Кальций соединяется с серой в соотношении 5:4. Какие массы кальция и серы
потребуются для получения 180 г сульфида кальция?
535. Железо соединяется с серой в массовом отношении 7:4. Укажите массы железа и
серы, необходимых для получения из простых веществ 88 г сульфида железа (II).
536. Алюминий соединяется с серой в соотношении 9:16. Укажите массу алюминия и
массу серы, необходимых для получения 25 г сульфида алюминия.
537. Магний взаимодействует с кислородом в соотношении 3:2. Укажите массы
магния и кислорода, которые необходимы для получения 35 г оксида магния.
538. Медь взаимодействует с серой в массовом отношении 4:1. Укажите массы серы
и меди, которые необходимы для получения 45 г сульфида меди (I).
539. Кальций взаимодействует с кислородом в соотношении 5:2. Укажите массы
кальция и кислорода, которые необходимы для получения 112 г оксида кальция.
540. Кальций взаимодействует с кислородом в соотношении 5:2. Укажите массы
кальция и кислорода, которые необходимы для получения 22,4 г оксида кальция.
541. Чему равна масса железной окалины (Fe3O4), полученной окислением железа
массой 1,68 г кислородом массой 0,64 г?
542. При разложении
4,44 г малахита образуется
3,2 г СuO и
0,36 г воды и
углекислый газ. Определите, какая масса углекислого газа СО2 образуется.
543. При нагревании Ag2O образовалось 43,2 г Ag и 3,2 г O2. Какова была масса
разложившегося оксида?
544. Определите массу углекислого газа, полученного прокаливанием
100 г
известняка, если известно, что в результате реакции получено 56 г оксида кальция.
545. С целью получения сульфида алюминия была подвергнута нагреванию на
воздухе смесь 54 г алюминия и 96 г серы. Вычислите массу продукта реакции.
546. С целью получения сульфида алюминия была подвергнута нагреванию на
воздухе смесь 27 г алюминия с 48 г серы. Вычислите массу продукта реакции.
547. Красный порошок меди массой 6,4 г смешали с желтым порошком серы массой
3,2 г и нагрели. Какова масса полученного черного порошка?
548. Сожгли 5 г серы, при этом образовался оксид серы (IV) массой 10 г. Вычислите,
какая масса кислорода прореагировала?
549. Сожгли
10 г серы, при этом образовался оксид серы (IV) массой
20 г.
Вычислите, какая масса кислорода вступила в реакцию.
550. Сожгли
4 г кальция, при этом образовался оксид кальция массой
5,6 г.
Вычислите массу прореагировавшего кислорода.
551. Какая масса Р2О5 образовалась, если в 16 г кислорода сожгли 12,4 г фосфора?
552. Вычислите массу магния, вступившего в реакцию с кислородом массой 12 г,
если при этом образуется 30 г MgO.
553. Вычислите массу магния, вступившего в реакцию с кислородом массой 6 г, если
при этом образуется 15 г MgO.
554. Определите массу оксида кальция, полученного прокаливанием 10 г карбоната
кальция, если известно, что в результате реакции получено 4,4 г углекислого газа.
555. При взаимодействии 48 г кислорода с алюминием образовался оксид алюминия
массой 102 г. Определите массу алюминия, вступившего в реакцию.
556. Вычислите массу кислорода, вступившего в реакцию с магнием массой 36 г,
если при этом образуется 60 г MgO.
557. Сожгли 3,1 г фосфора, при этом образовался оксид фосфора (V) массой 7,1 г.
Какая масса кислорода вступила в реакцию?
558. Вычислите объем кислорода (при н.у.), который потребуется для получения
оксида серы (IV) путем сжигания сероводорода объемом 44,8 л.
559. Вычислите количество вещества кислорода, который прореагирует с алюминием
количеством вещества 0,8 моль.
560. Вычислите, какая масса водорода прореагировала с кислородом массой 16 г,
если образовалось 18 г воды?
561. При взаимодействии
10 г кальция с хлором образовалось
27,75 г продукта
реакции. Какая масса хлора прореагировала?
562. В результате разложения 98 г бертолетовой соли получили кислород и хлорид
калия массой 59,6 г. Определите массу кислорода, выделившегося в результате реакции.
563. Вычислите, какая масса оксида ртути (II) разложилась, если при этом
образовалось 32 г кислорода и 402 г ртути.
564. Вычислить количество вещества продукта реакции, образованного при
взаимодействии 2 моль алюминия с хлором.
565. При взаимодействии 27 г алюминия с кислородом образовался оксид алюминия
массой 51 г. Определите массу кислорода, вступившего в реакцию.
566.
20 г кальция вступило в реакцию с
8 г кислорода. Определите массу
полученного оксида кальция.
567.
10 г кальция вступило в реакцию с
4 г кислорода. Определите массу
полученного оксида кальция.
568. При сгорании 8 г метана образовалось 22 г углекислого газа и 18 г воды. Какая
масса кислорода участвовала в химической реакции?
569. Укажите объем продукта (при н.у.), который образуется при сгорании 5 л оксида
углерода (ІІ) в 2 л кислорода.
570. Вычислите объем кислорода (при н.у.), который потребуется для окисления 90 л
оксида углерода (II).
571. Вычислите объем кислорода (при н.у.), который потребуется для окисления 10 л
оксида углерода (II).
572. Определите объем хлора (при н.у.), который израсходовали для синтеза 50 л
хлороводорода.
573. Определите, какой объем газа останется не израсходованным в процессе
взаимодействия 56 л оксида серы (IV) и 48 л кислорода (н.у.).
574. Вычислите объем кислорода (при н.у.), который необходим для окисления 20 л
оксида азота (II).
575. Вычислите объем кислорода
(при н.у.), который потребуется для
каталитического окисления 180 л оксида серы (IV).
576. Вычислите объем кислорода (при н.у.), необходимый для получения оксида
серы (IV) из сероводорода объемом 89,6 л.
577. Вычислите количество вещества алюминия, который прореагирует с кислородом
количеством вещества 0,6 моль.
578. Вычислите количество вещества алюминия, который вступил в реакцию с серой,
если при этом образовалось 0,2 моль сульфида алюминия.
579. Определите объем водорода (при н.у.), который необходим для синтеза 200 л
аммиака.
580. Определите объем водорода (н.у.), который вступит в реакцию с азотом с
образованием 10 л аммиака.
581. Определите объем азота (н.у.), который вступит в реакцию с водородом с
образованием 20 л аммиака.
582. Определите объем водорода (при н.у.), который необходим для синтеза 200 л
аммиака.
583. Определите объем водорода (при н.у.), который потребуется для получения 30 л
аммиака из простых веществ.
584. Определите объем водорода (при н.у.), который израсходовали для синтеза 10 л
хлороводорода.
585. Определите объем хлора (при н.у.), который израсходовали для синтеза 25 л
хлороводорода.
586. Определите объем хлороводорода (при н.у.), который можно получить из 40 л
хлора.
587. Определите объем хлороводорода (при н.у.), который можно получить из 120 л
хлора.
588. Вычислите объем кислорода
(при н.у.), который необходим для полного
окисления 20 л оксида азота (II).
589. Определите объем кислорода (н.у.), необходимый для полного сгорания 15 л
этана.
590. Определите объем кислорода (н.у.), необходимый для полного сгорания 10 л
этана.
591. Вычислите объем кислорода (при н.у.), необходимый для полного сгорания 40 л
бутана.
592. Вычислите объем кислорода (при н.у.), необходимый для полного сгорания 20 л
бутана.
593. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 100 л пропена.
594. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 2 моль пропана.
595. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 60 л пропана.
596. Определите объем кислорода
(при н.у.), который потребуется для полного
окисления 120 л пропана.
597. Найдите объем оксида углерода (IV) (при н.у.), выделившегося при спиртовом
брожении 36 г глюкозы.
598. Вычислите объем углекислого газа
(н.у.), который выделится при полном
окислении 35 л ацетилена.
599. Вычислите объем углекислого газа
(н.у.), который выделится при полном
окислении 70 л ацетилена.
600. Определите объем углекислого газа (при н.у.), который образуется при сгорании
метана в 80 л кислорода.
601. Определите объем углекислого газа (при н.у.), который образуется при сгорании
метана в 40 л кислорода.
602. Определите объем азота
(н.у.), который выделится при сжигании
20 л
метиламина.
603. Определите объем ацетилена (при н.у.), для полного гидрирования которого
израсходовали 200 л водорода.
604. Определите объем ацетилена (при н.у.), для полного гидрирования которого
израсходовали 100 л водорода.
605. Определить объем ацетилена (при н.у.), который образуется при нагревании
140 л метана.
606. Определить объем ацетилена (при н.у.), который образуется при термическом
крекинге 280 л метана.
607. Определите объем хлора
(при н.у.), который потребуется для полного
хлорирования 120 л метана до тетрахлорметана.
608. Определите объем хлора
(при н.у.), который потребуется для полного
хлорирования 40 л метана до тетрахлорметана.
609. Вычислите объём углекислого газа
(н.у.), который выделится при полном
сгорании 6 л этина.
610. Определите объем этана
(при н.у.), который образуется при полном
гидрировании 360 л ацетилена.
611. Определите максимальный объем (при н.у.) бромоводорода, который может
присоединить 0,25 моль ацетилена.
612. Закончите предложение: «по правилу Вант-Гоффа с повышением температуры
на каждые 10°С скорость реакции ___________ª.
613. Реакция между двумя газообразными веществами проходит по уравнению
А2 + 2В = 2АВ. Как изменится скорость этой реакции при увеличении давления в 6 раз?
614. Вычислите температурный коэффициент скорости реакции
(значение,
показывающее во сколько раз возрастает скорость реакции при повышении температуры на
каждые 10°С), если при повышении температуры на 20°С скорость реакции возрастает в
9 раз.
615. Вычислите во сколько раз увеличивается скорость реакции при повышении
температуры с 50°С до 80°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
616. Вычислите во сколько раз увеличивается скорость реакции при повышении
температуры с 70°С до 90°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
617. При повышении температуры на каждые 10°С скорость химической реакции
возрастает в 2 раза. На сколько градусов надо увеличить температуру, чтобы скорость
реакции увеличилась в 16 раз?
618. На сколько градусов следует повысить температуру, чтобы скорость реакции
повысить в 81 раз, учитывая, что при повышении температуры на каждые 10°С скорость
реакции возрастает в 3 раза?
619. На сколько градусов следует повысить температуру, чтобы скорость реакции
повысить в 27 раз, учитывая, что при повышении температуры на каждые 10°С скорость
реакции возрастает в 3 раза?
620. Укажите, во сколько раз увеличится скорость химической реакции, если
повысить температуру от +20°С до +80°С, учитывая, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
621. Вычислите, во сколько раз увеличится скорость химической реакции при
увеличении температуры на 30°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
622. При повышении температуры на каждые 10°С скорость реакции возрастает в
2,8 раза. Во сколько раз возрастет скорость реакции при повышении температуры от 55°С до
75°С?
623. При повышении температуры на каждые 10°С скорость химической реакции
возрастает в 2,5 раза. Как изменится ее скорость при охлаждении реакционной смеси от
изменения температуры от 50°С до 30°С?
624. При повышении температуры на каждые 10°С скорость реакции возрастает в 2,5
раза. Во сколько раз возрастет скорость реакции при повышении температуры от 45°С до
65°С?
625. Во сколько раз увеличится скорость реакции, если повысить температуру на
20°С, если известно, что при повышении температуры на каждые 10°С скорость реакции
увеличивается в 2,3 раза?
626. Укажите, во сколько раз увеличится скорость реакции, если повысить
температуру от 10°С до 50°С, учитывая, что при повышении температуры на каждые 10°С
скорость реакции возрастает в 2 раза.
627. Вычислите, во сколько раз увеличится скорость химической реакции при
увеличении температуры на 40°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции увеличивается в 2 раза.
628. Во сколько раз увеличится скорость реакции гидролиза сахарозы при
повышении температуры с 27°С до 47°С, если известно, что при повышении температуры на
каждые 10°С скорость реакции возрастает в 3 раза?
629. Определите, как изменится скорость некоторой реакции при повышении
температуры от 10°С до 50°С, если известно, что при повышении температуры на каждые
10°С скорость реакции увеличивается в 3 раза.
630. Определите, как изменится скорость некоторой реакции при повышении
температуры от 0°С до 10°С, если известно, что при повышении температуры на каждые
10°С скорость реакции возрастает в 3 раза.
631. Реакция при температуре
50°С протекает за
180 с. Учитывая, что при
повышении температуры на каждые 10°С скорость реакции увеличивается в 3 раза, укажите
время протекания этой реакции при температуре 70°С.
632. Начальная скорость реакции при 40°С составляет 0,54 моль/л∙мин. Вычислите
скорость этой реакции при температуре 50°С, если при повышении температуры на каждые
10°С скорость химической реакции возрастает в 3 раза.
633. При 150°С некоторая реакция заканчивается за 8 минут. Принимая, что при
повышении температуры на 10°С скорость реакции возрастает в 2 раза, определите, через
какое время закончится эта реакция, если проводить ее при 170°С.
634. В системе СО (г) + Сl2 (г)
СОСl2 (г) концентрацию угарного газа увеличили с
1,2 моль/л до 1,5 моль/л, а хлора - с 1,25 моль/л до 2 моль/л. Во сколько раз увеличилась
при этом скорость реакции?
635. Константа скорости реакции А + 2В = С, k = 0,1 л∙моль−1∙с−1. Определите
скорость реакции при концентрациях А = 4 моль/л и В = 3 моль/л.
636. Рассчитайте скорость реакции между растворами хлорида калия и нитрата
серебра, концентрации которых составляют соответственно
0,2 и
0,3 моль/л, а
k = 1,5∙10−3 л∙моль−1∙с−1.
637. Средняя скорость разложения оксида азота (V) на простые вещества при 67°С
равна 0,25 моль/(л∙мин). Определите время полураспада N2O5 при начальной концентрации
1 моль/л.
638. Вычислите среднюю скорость реакции CO + Cl2 = COCl2, если начальная
концентрация хлора была равна 1,2 моль/л, а через 6 секунд стала равной 0,6 моль/л.
639. Вычислите среднюю скорость реакции CO + Cl2 = COCl2, если начальная
концентрация хлора была равна 1 моль/л, а через 4 секунды стала равной 0,6 моль/л.
640. Вычислите среднюю скорость реакции CO + NO2 = CO2 + NO, если начальная
концентрация оксида углерода (ΙΙ) была равна 2 моль/л, а через 5 секунд стала 0,5 моль/л.
641. Определите среднюю скорость гомогенной реакции А + В = С, если начальная
концентрация вещества В была 0,84 моль/л, а через 20 секунд стала 0,62 моль/л.
642. Вычислите среднюю скорость гомогенной реакции A2 + 2B2 = 2AB2, если
начальная концентрация вещества А2 была равна 1,3 моль/л, а через 30 секунд снизилась до
0,4 моль/л.
643. Химическая реакция протекает в растворе согласно уравнению А + В = С.
Начальная концентрация вещества А составляла 0,80 моль/л, а вещества В - 1,00 моль/л.
Спустя 20 секунд концентрация А снизилась до 0,78 моль/л. Вычислите среднюю скорость
реакции.
644. Начальная концентрация оксида серы (ΙV) в реакции его окисления до оксида
серы (VΙ) была 2 моль/л, а через 50 секунд стала 0,5 моль/л. Определите среднюю скорость
реакции.
645. Укажите, во сколько раз возрастет скорость реакции если повысить температуру
от 40°С до 70°С, если при увеличении температуры на каждые 10°С скорость реакции
увеличивается в 4 раза.
646. В начальный момент времени концентрация исходного вещества (х) была равна
2 моль/л. Определить концентрацию вещества (х) через одну минуту, если скорость реакции
равна 0,01 моль/л∙сек.
647. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при повышении давления:
C3H8 (г) + 5O2 (г) ⇄ 3CO2 (г) + 4H2O (г)
648. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении температуры:
C (т) + 2N2O (г) ⇄ CO2 (г) + 2N2 (г) + Q
649. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении температуры:
C (т) + 2Cl2 (г) ⇄ CCl4 (г) + Q
650. На основании принципа Ле Шателье определите, в каком направлении сместится
равновесие в следующей системе при понижении давления:
CH4 (г) + 4S (т) ⇄ CS2 (г) + 2Н2S (г)
651. На основании принципа Ле Шателье, определите, в каком направлении
сместится равновесие в следующей системе при повышении давления (Т = const):
CH4 (г) + 4S (т) ⇄ CS2 (г) + 2Н2S (г)
652. Определите, в каком направлении сместится равновесие в следующей системе
при повышении давления:
2С2Н2 (г) + 5О2 (г) ⇄ 4СО2 (г) + 2Н2О (г) + 2610 кДж
653. В какую сторону сместится химическое равновесие в реакции, уравнение
которой
2CO + O2 ⇄ 2CO2 + Q,
в случае повышения температуры.
654. В какую сторону сместится химическое равновесие реакции, уравнение которой
4HCl (г) + O2 (г) ⇄ 2H2O (г) + 2Cl2 (г) + Q
в случае увеличения давления?
655. В какую сторону сместится равновесие при увеличении концентрации кислорода
в системе:
2SO2 + O2 ⇄ 2SO3+ Q
656. Укажите, как необходимо изменить температуру для того, чтобы сместить
равновесие реакции вправо:
2Nа (т) + Cl2 (г) ⇄ 2NаСl (т) + 411,3 кДж
657. Укажите, как необходимо изменить температуру протекания реакции для того,
чтобы сместить равновесие реакции в сторону продуктов реакции:
2НВr (г) ⇄ Н2 (г) + Вr2 (г) - Q
658. Укажите, как необходимо изменить концентрацию исходных веществ и
температуру для того, чтобы сместить вправо равновесие реакции:
N2 (г) + О2 (г) ⇄ 2NO (г) - Q
659. Укажите, как необходимо изменить давление для того, чтобы сместить
равновесие в сторону образования CO по реакции:
С (т) + СO2 (г) ⇄ 2СО (г)
660. Определите, увеличится ли количество фторида азота (ІІІ) при повышении
давления в системе:
6HF (г) + N2 (г) ⇄ 2NF3 (г) + 3H2 (г) - Q
661. Укажите, как необходимо изменить давление для того, чтобы сместить вправо
равновесие реакции:
N2 (г) + 3Н2 (г) ⇄ 2NH3 (г) + Q
662. Укажите, как необходимо изменить температуру для того, чтобы сместить
равновесие реакции вправо:
2H2S (г) + O2 (г) ⇄ 2H2O (г) + 2S (г) + Q
663. Укажите, как необходимо изменить температуру для того, чтобы сместить влево
равновесие реакции:
2H2S (г) + O2 (г) ⇄ 2H2O (г) + 2S (т) + Q
664. Укажите, как необходимо изменить температуру для того, чтобы сместить
равновесие реакции влево:
2Nа (т) + Cl2 (г) ⇄ 2NаСl (т) + 411,3 кДж
665. Укажите, как необходимо изменить температуру для того, чтобы сместить влево
равновесие реакции:
S (т) + 2СО2 (г) ⇄ SO2 (г) + 2СО - 269 кДж
666. Укажите, в какую сторону сместится равновесие реакции
Fe3O4 (т) + 4СO (г) ⇄ 3Fe (т) + 4СO2 (г) Н = +43,7 кДж
с повышением температуры.
667. Выберите и запишите в ответе уравнение, в котором при увеличении давления
химическое равновесие не смещается:
2H2 (г) + O2 (г) ⇄ 2H2O (г)
H2 (г) + Cl2 (г) ⇄ 2HCl (г)
668. Укажите, в какой системе изменение давления не повлияет на состояние
химического равновесия
2NO (г.) + O2 (г.) ⇄ 2NO2
(г.)
N2 (г.) + O2 (г.) ⇄ 2NO (г.)
669. Как нужно изменить концентрации реагирующих веществ в системе
СО (г) + Н2О (г) ⇄ СО2 (г) + Н2 (г),
чтобы увеличить выход продуктов реакции?
670. Эндотермическая реакция разложения пентахлорида фосфора протекает по
уравнению:
РСl5 (г) ⇄ РСl3 (г) + Сl2 (г) - 92,59 кДж.
Как надо изменить давление и температуру, чтобы сместить равновесие в сторону прямой
реакции - разложения РСl5?
671. Эндотермическая реакция разложения пентахлорида фосфора протекает по
уравнению
РСl5 (г) ⇄ РСl3 (г) + Сl2 (г) - 92,59 кДж.
Как надо изменить давление, чтобы сместить равновесие в сторону обратной реакции?
672. Определите, увеличится ли выход продуктов при одновременном повышении
температуры и давления в системе:
6HF (г) + N2 (г) ⇄ 2NF3 (г) + 3H2 (г) - Q
673. Укажите факторы, способствующие смещению вправо равновесия реакции:
СО (г) + Н2O (г) ⇄ СО2 (г) + Н2 (г) + Q
674. Укажите, как повлияет снижение температуры на содержание NO2 в
равновесной системе:
2NO2 (г) ⇄ N2O4 (г) + Q
675. Теплота образования 1 моль оксида меди (ІІ) из простых веществ составляет
154,5 кДж. Определите, сколько выделится теплоты при взаимодействии
512 г меди с
кислородом.
676. При горении фосфора в избытке кислорода тепловой эффект реакции 3010 кДж.
Определите массу фосфора, если при сгорании выделилось 75,25 кДж теплоты.
677. При сгорании
2 моль цинка в кислороде выделяется
696 кДж теплоты.
Определите массу образца цинка, если при его сгорании выделилось 10,44 кДж теплоты.
678. При горении магния массой 1,2 г выделилось 31 кДж теплоты. Определите
тепловой эффект реакции. Напишите термохимическое уравнение этой реакции.
679. В соответствии с термохимическим уравнением реакции:
2NаНСO3 = Nа2СO3 + СО2 + Н2O - 64 кДж
определите, какое количество теплоты затрачивается на превращение 126 г гидрокарбоната
натрия в карбонат натрия.
680. В результате реакции, термохимическое уравнение которой
2AgNO3 (тв.) = 2Ag (тв.) + 2NO2 (г.) + O2 (г.) - 317 кДж
поглотилось 63,4 кДж теплоты. Вычислите массу выделившегося кислорода.
681. В соответствии с термохимическим уравнением реакции:
2NаНСO3 (т) = Nа2СO3 (т) + СО2 (г) + Н2O (г) - 64 кДж
определите, какое количество теплоты затрачивается на превращение 252 г гидрокарбоната
натрия в карбонат натрия.
682. В соответствии с термохимическим уравнением реакции:
2Са + O2 = 2СаО Н = -1274 кДж
Определите количество теплоты, выделившееся при сгорании 100 г кальция.
683. В соответствии с термохимическим уравнением реакции
2Nа + Cl2 = 2NаСl + 411,3 кДж
определите количество теплоты, которое выделится при окислении
0,4 моль натрия в
избытке хлора.
684. В соответствии с термохимическим уравнением реакции:
2Nа + Cl2 = 2NаСl + 411,3 кДж
определите количество теплоты, которое выделится при окислении 4 моль натрия в избытке
хлора.
685. В соответствии с термохимическим уравнением реакции:
2Nа (т) + Cl2 (г) ⇄ 2NаСl (т) + 411,3 кДж
Определите количество теплоты, которое выделится при окислении 8 моль натрия в избытке
хлора.
686. Определите количество теплоты, которое поглотится при окислении 48 г серы
по термохимическому уравнению реакции:
S + 2СО2 = SO2 + 2СО - 269 кДж
687. Определите количество теплоты, которое поглотится при окислении 96 г серы
по термохимическому уравнению реакции:
S (т) + 2СО2 (г) = SO2 (г) + 2СО - 269 кДж
688. Определите, сколько требуется затратить теплоты для получения 25 г железа
согласно уравнению:
Fe2O3 (т) + 3СО (г) ⇄ 2Fe (т) + 3СO2 (г) - 27 кДж
689. В соответствии с термохимическим уравнением
3Fe3O4 + 8Аl = 9Fe + 4Аl2O3 + Q
получили 1,68 г железа и при этом выделилось 11,08 кДж теплоты. Определите тепловой
эффект реакции.
690. По термохимическому уравнению
2NaOH + H2SO4 = Na2SO4 + 2H2O + 290 кДж
вычислите массу гидроксида натрия, вступившего в реакцию, если известно, что при его
нейтрализации выделилось 725 кДж теплоты.
691. По термохимическому уравнению
2KNO3 = 2KNO2 + O2 - 255 кДж
вычислите количество теплоты, которая поглотится при получении кислорода (н.у.) объемом
6,72 л.
692. Рассчитайте, сколько выделится теплоты при образовании
44,8 л (н.у.)
газообразного аммиака согласно термохимическому уравнению:
N2 + 3Н2 = 2NH3 + 92 кДж
693. Вычислите количество теплоты, которое выделится при каталитическом
окислении 89,6 л аммиака по термохимическому уравнению реакции:
4NH3 + 5O2 = 4NO + 6H2O + 1169 кДж
694. В результате реакции, термохимическое уравнение которой
CaO (т) + H2O (ж) = Ca(OH)2 (т) + 70 кДж,
выделилось 210 кДж теплоты. Вычислите массу образовавшегося при этом гидроксида
кальция.
695. В результате реакции, термохимическое уравнение которой
NН4NO2 = N2 + 2H2O + 316 кДж
выделилось 94,8 кДж теплоты. Определите массу разложившейся соли.
696. Сколько выделится теплоты при разложении
36,6 г оксида хлора (VІІ)
в
соответствии с термохимическим уравнением реакции:
2Сl2О7 = 2Сl2 + 7О2 + 570 кДж
697. В результате реакции, термохимическое уравнение которой
2AgNO3 = 2Ag + 2NO2 + O2 - 317 кДж
поглотилось 15,85 кДж теплоты. Вычислите массу выделившегося серебра.
698. В соответствии с термохимическим уравнением реакции
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
определите объем метана, при сгорании которого выделяется 2200 кДж теплоты.
699. В соответствии с термохимическим уравнением реакции
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г) + 880 кДж
определите объем метана, при сгорании которого выделяется 1762 кДж теплоты.
700. В соответствии с термохимическим уравнением реакции
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
определите объем метана, при сгорании которого выделяется 1100 кДж теплоты.
701. В соответствии с термохимическим уравнением реакции
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
определите количество теплоты, выделившееся при окислении 89,6 л метана.
702. Согласно термохимическому уравнению реакции
СН4 (г) + 2O2 (г СO2 (г) + 2Н2O (ж) + 802 кДж
определите количество теплоты, выделившейся при сжигании 48 г метана.
703. В результате реакции, термохимическое уравнение которой
2С2Н2 + 5O2 = 4СO2 + 2Н2O + 2610 кДж,
выделилось 6525 кДж теплоты. Определите объем сгоревшего ацетилена.
704. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж
выделилось 687 кДж теплоты. Вычислите количество вещества этанола.
705. Определите количество вещества этанола, если в результате реакции,
термохимическое уравнение которой
С2Н5ОН (ж) + 3O2 (г)
2СO2 (г) + 3Н2O (г) + 1374 кДж
выделилось 68,7 кДж теплоты.
706. Определите количество вещества этанола, вступившего в реакцию, если в
результате реакции, термохимическое уравнение которой
С2Н5ОН + 3O2 = 2СO2 + 3Н2O + 1374 кДж,
выделилось 137,4 кДж теплоты.
707. В соответствии с термохимическим уравнением
С6Н12O6 + 6O2 = 6CO2 + 6H2O + 2800 кДж
определите, какое количество теплоты выделится при образовании 2,4 моль углекислого
газа.
708. В соответствии с термохимическим уравнением
С6Н12O6 (т) + 6O2 (г)
6CO2 (г) + 6H2O (г) + 2800 кДж
Определите, какое количество теплоты выделится при образовании 1,2 моль углекислого
газа.