Новая инструкция Росздравнадзора по маркировке лекарств - 2019 год
Медицинская экспертиза и управление качеством
Новая инструкция Росздравнадзора
по маркировке лекарств.
Как применить на практике
ВАЖНОЕ В СТАТЬЕ
1
Оформите усиленную квалифицированную электронную подпись
на руководителя медорганизации
2
Проверяйте достоверность и полноту информации, которую вносите в систему
маркировки лекарств, чтобы не отказали в регистрации и не заблокировали
сведения
3
Регистрируйте в системе информацию о вводе, обороте или выводе из оборота
лекарств
Медорганизации должны вступить в мониторинг движе-
ния лекарств до 1 января 2020 года*. Закупать и применять
препараты, информацию о которых не внесли в систему
«Маркировка», запретят.
Росздравнадзор утвердил порядок с инструкцией, как
Сергей Лытаев, профессор,
подключить клиники к системе маркировки**. Эксперты
заместитель руководителя,
ведомства разъяснили, как применить ее на практике.
д. м. н.
Комплект документов прилагается.
Ольга Махова, начальник
отдела контроля и надзора
за медицинской, фармацев-
тической деятельностью
Как зарегистрироваться в системе
и деятельностью, связан-
ной с оборотом наркотиче-
Наберите в поиске
«честный знак» и перейдите
ских средств и психотропных
веществ, к. м. н.
на портал национальной системы цифровой маркиров-
66
Заместитель главного врача
№7, июль 2019 года
ки честныйзнак.рф. Найдите раздел системы мониторинга
Ирина Зернова, замести-
тель начальника отдела кон-
движения лекарственных препаратов для медпримене-
троля и надзора за меди-
ния - mdlp.crpt.ru - и создайте на портале личный кабинет.
цинской, фармацевтической
В аккредитованном удостоверяющем центре Мин-
деятельностью и деятельно-
комсвязи оформите руководителю клиники усиленную
стью, связанной с оборо-
том наркотических средств
квалифицированную электронную подпись, далее - УКЭП
и психотропных веществ
(Федеральный закон от 06.04.2011 № 63-ФЗ «Об электронной
подписи», постановление Правительства от 25.06.2012 № 634
Территориальный орган
<О видах электронной подписи…>). Перечень центров
Росздравнадзора по Санкт-
Петербургу и Ленинградской
по адресу minsvyaz.ru в разделе «Деятельность».
области
На компьютере, с которого планируете входить в систе-
му, установите сертификаты ключей проверки электрон-
ной подписи, программы для работы с подписью и защиты
информации. Установите средство криптографической
защиты информации (СКЗИ), которое содержит крипто-
провайдер (CSP) с поддержкой ГОСТ Р 34.10-2012. Перечень
средств защиты информации, которые сертифицировала
* Федеральный
закон от 28.12.2017
ФСБ, - на clsz.fsb.ru в разделе «Сертификация».
№ 425-ФЗ «О внесении из-
Нажмите на сайте кнопку «Проверка доступа» - систе-
менений в Федеральный
ма автоматически проверит возможность подключения
закон "Об обращении
лекарственных средств"»,
компьютера и предоставит инструкции по настройке.
ч. 7 ст. 67 Федерального
Заполните реквизиты электронной заявки и нажмите
закона от 12.04.2010
№ 61-ФЗ «Об обращении
кнопку «Зарегистрироваться».
лекарственных средств»
Дождитесь уведомления об успешной регистрации
** Информационное
на электронную почту. Активируйте личный кабинет.
письмо Росздравнадзора
от 20.05.2019 № 01и-
Внесите в систему юридические адреса, которые указаны
1269/19 «О соблюдении
в лицензии на меддеятельность и фармдеятельность.
действующего законода-
Подпишите сведения УКЭП.
тельства»
К СВЕДЕНИЮ
Проект по маркировке и мониторингу движе-
сифицированной продукции. Для участников
ния лекарств для медприменения стартовал
эксперимента Минздрав разработал Мето-
в феврале 2017 года и завершится 31 дека-
дические рекомендации от 23.04.2018. За год
бря 2019 года. Цель - противодействовать про-
эксперимента выявили нарушений на пол-
изводству и обороту контрафактной и фаль- миллиарда рублей.
67

Медицинская экспертиза и управление качеством
Как заполнить заявление
Как зарегистрировать место
деятельности
После регистрации в системе направьте оператору
заявку на тестирование процессов информационного
взаимодействия.
Порядок процедуры прописали в Положении о систе-
ме мониторинга движения лекарственных препаратов
для медицинского применения (постановление Прави-
тельства от 14.12.2018 № 1556, далее - Постановление
№ 1556).
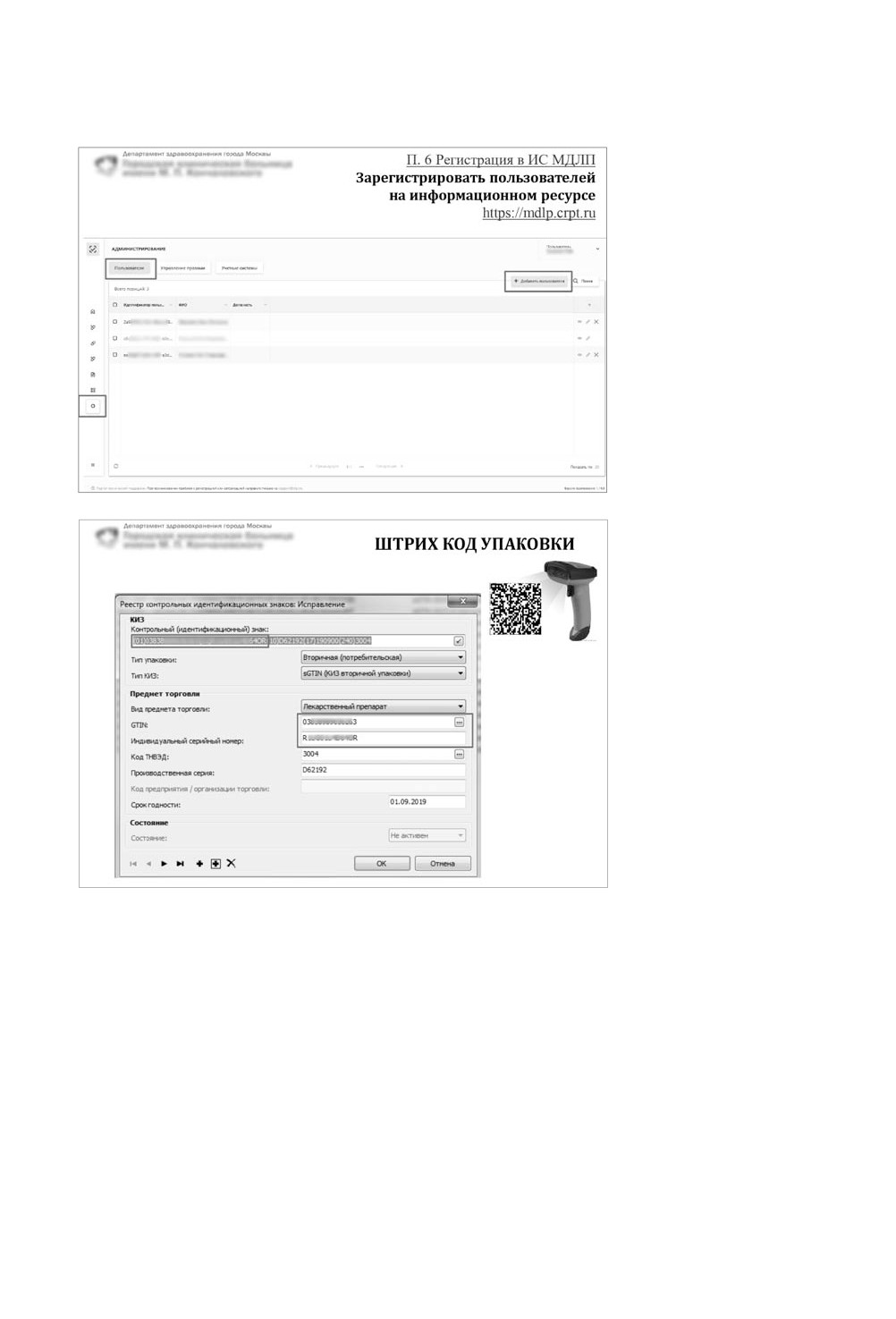
Поэтапная регистрация в системе - на скриншотах.
68
Заместитель главного врача
№7, июль 2019 года
Как зарегистрировать
пользователей
Как работать со штрихкодом
упаковки
Когда в регистрации могут отказать
Заявление о регистрации рассматривает оператор системы
цифровой маркировки товаров на базе ООО «Центр раз-
вития перспективных технологий». Он может отказать,
если выявит расхождения или недостоверные данные.
Прежде чем отправить заявку на портале системы
мониторинга, проверьте информацию в сертификате
УКЭП руководителя медорганизации на gosuslugi.ru/pgu/eds.
69

Медицинская экспертиза и управление качеством
Личный кабинет в системе
70
Заместитель главного врача
№7, июль 2019 года
Убедитесь, что Ф. И. О. и ИНН владельца соответству-
ют ЕГРЮЛ (ст. 14 Федерального закона от 06.04.2011
№ 63-ФЗ «Об электронной подписи»).
В заявке должны быть сведения, что клиника за-
Важно
регистрирована в ЕГРЮЛ или ЕГРИП, есть лицензии
Схемы процессов регистра-
на медицинскую и фармацевтическую деятельность
ции и внесения информа-
Росздравнадзора. Для лицензий на фармдеятельность
ции в систему мониторинга
проверьте, что вписали адрес, по которому клиника рабо-
на roszdravnadzor.ru в раз-
тает в федеральной информационной адресной системе,
деле «Система маркировки
и присвоен уникальный ID.
лекарственных препаратов
Если клиника не зарегистрирована как юридическое
(пилотный проект)»
лицо или индивидуальный предприниматель, регистра-
и честныйзнак.рф/
цию может заблокировать ФНС. Если в госреестре аккре-
business/projects/21/
дитованных филиалов и представительств иностранных
организаций она не значится как действующий филиал
или представительство иностранной организации. ФНС
проверит записи о клинике в ЕГРЮЛ. Убедитесь, что нет
недостоверной информации, опечаток (пп. 5, 6 ст. 11 Фе-
дерального закона «О государственной регистрации юри-
дических лиц и индивидуальных предпринимателей»).
Как вносить информацию в систему
После регистрации вносите в систему операции с лекар-
ствами. При первом входе в личный кабинет используйте
УКЭП руководителя. В дальнейшем другим пользовате-
лям системы, которые будут регистрировать действия
К СВЕДЕНИЮ
Росздравнадзор выбрал региональные цен-
из числа лечебных учреждений»). Учреж-
тры компетенций из медицинских и аптеч-
дения прошли обучение работе в системе
ных организаций (информационное письмо
и в дальнейшем должны тренировать субъ-
ведомства от 25.05.2018 № 04И-1304/18 «О про-
екты обращения лекарственных средств
ведении обучения центров компетенций в регионах.
71
Медицинская экспертиза и управление качеством
с лекарственными препаратами в клинике, оформите
УКЭП. Добавьте данные сотрудников на сайте в личном
кабинете
Заносите в систему информацию о передаче препаратов
в структурные подразделения внутри клиники по адре-
сам, которые указаны в лицензии на меддеятельность.
Регистрируйте вывод лекарств из оборота, когда выдаете
препарат по льготному рецепту, отпускаете для медпри-
менения или передаете на уничтожение.
Информацию о выводе лекарственных препаратов
из оборота при отпуске по рецептам пациентам со сто-
процентной льготой и при отпуске в медорганизациях
клиники оформите с помощью регистратора выбытия.
Регистратор предоставит оператор.
При вводе в оборот лекарств в системе между органи-
зациями оптовой торговли и медорганизациями данные
в систему может вносить любая сторона. Работать можно
по прямому порядку и обратному.
При прямом документы об отгрузке в систему за-
гружает поставщик. В этом случае сотрудник клиники
подтверждает прием товара или отказывается от него.
Если подтверждает, то регистрирует в системе, что товар
получили и согласны с данными системы.
При обратном документы о товарах, которые посту-
пили, загружает клиника, а поставщик подтверждает
К СВЕДЕНИЮ
В ходе эксперимента маркируют в первую
ней. Срок обязательной маркировки таких
очередь лекарственные препараты для
препаратов наступит с 1 октября 2019 года.
больных гемофилией, муковисцидозом,
Штрафовать за нарушения начнут с 1 ян-
гипофизарным нанизмом, болезнью Гоше,
варя 2020 года.
злокачественными новообразованиями
Препараты маркируют двухмерным штрих-
лимфоидной, кроветворной и родственных
кодом. По нему пациент через мобильное
им тканей, рассеянным склерозом, пациен-
приложение может проверить легальность
тов после трансплантации органов и тка- лекарства.
72
Заместитель главного врача
№7, июль 2019 года
или отклоняет отгрузку товара в учреждение. При этом
нужно получить ответ от информационной системы
по данным о препарате, узнать, правильные они или нет.
Каждое действие, связанное с обращением лекарственного
Совет
препарата, оформляйте документом в формате XML и за-
Если возникнут сложности
гружайте в систему.
при регистрации в системе
Срок в обоих случаях - пять рабочих дней с момента
маркировки, обратитесь
отгрузки или приемки (Постановление № 1556).
в службу технической под-
держки ООО «Оператор-
ЦРПТ» по телефону
Когда и как начнут штрафовать
8-800-222-15-23, почте
support@crpt.ru или через
Последний день, когда клиники могут зарегистриро-
форму обратной связи
ваться в системе мониторинга - 31 декабря 2019 года.
на сайте
С 1 января 2020 года контролеры начнут штрафовать,
если медорганизация не работает в системе.
За нарушение порядка мониторинга клинику оштра-
фуют на 100 тыс. руб., должностное лицо, ответственное
за систему мониторинга движения лекарственных пре-
паратов для медприменения, - на 10 тыс. руб. (6.34 КоАП).
Если систему не организовали, оштрафуют главного
врача. Участие в системе сейчас добровольное.
Чтобы не сорвать сроки регистрации, воспользуйтесь
алгоритмом «Как подготовить клинику к работе в систе-
ме мониторинга движения лекарственных препаратов»
в приложении 1.
К СВЕДЕНИЮ
Фармкомпании будут обязаны маркировать
немаркированных препаратов будут штра-
продукцию идентификационными знаками
фовать на сумму до 300 тыс. руб. и конфи-
DataMatrix с 1 января 2020 года. За продажу сковать незаконные товары.
73
Медицинская экспертиза и управление качеством
Приложение 1
Алгоритм «Как подготовить клинику к работе
в системе мониторинга движения лекарственных
препаратов»
1
Шаг. Информировать персонал о новых требованиях. Сообщите сотруд-
никам, что планируете перейти к работе в Информационной системе «Мониторинг
движения лекарственных препаратов». Объясните, что с 2020 года клиники будут
обязаны регистрировать лекарства в этой системе.
2
Шаг. Создать рабочую группу по маркировке. Включите в группу начальни-
ков отделов информационных технологий, контрактной службы, заведующего апте-
кой, заместителей главврача по медицинской части, экономическим, хозяйственным
вопросам, а также по кадровой и правовой работе. Председатель - обычно главный
врач. Покажите алгоритм, по которому будете подключаться к системе маркировки
(приложение 2).
3
Шаг. Поручить персоналу изучить нормативные документы. Поручите
рабочей группе изучить нормативные документы по системе маркировки (перечень
в приложении 3).
4
Шаг. Издать локальные акты. В приказе обяжите подчиненных внедрить
в клинике Методические рекомендации для проведения эксперимента по маркировке
лекарств (приложение 4). Сделайте их приложением к приказу. Еще в одном прило-
жении утвердите состав рабочей группы и назначьте ответственных. Поручите подать
заявку на участие в системе мониторинга. Ознакомьте с другими локальными актами
клиники. Например, схемой работы медучреждения от закупки препарата до выдачи
в отделение.
5
Шаг. Получить квалифицированную электронную подпись. Клиника
не сможет зарегистрироваться в системе маркировки, если у руководителя нет
усиленной квалифицированной электронной подписи. В дальнейшем подключайте
к системе специалистов клиники, которые будут работать с маркировкой. Для этого
получите на каждого из них подпись и заполните данные в системе.
74
Заместитель главного врача
№7, июль 2019 года
Шаг. Проверить лицензию клиники. У участников системы мониторинга ле-
6
карств должна быть лицензия на медицинскую или фармацевтическую деятельность.
Удостоверьтесь, что она зарегистрирована в федеральном органе исполнительной
власти.
7
Шаг. Зарегистрироваться в системе. Чтобы передавать данные в систему
мониторинга создайте личный кабинет на портале системы по адресу mdlp.crpt.ru.
Заполните заявку.
8
Шаг. Протестировать процессы информационного взаимодействия.
Направьте оператору заявку на тестирование и действуйте по порядку из постанов-
ления Правительства от 14.12.2018 № 1556.
9
Шаг. Доработать МИС. Проверьте, соответствует ли медицинская информа-
ционная система требованиям системы маркировки. Например, если МИС не под-
держивает УКЭП, ее нужно доработать или купить дополнительный программный
модуль.
10
Шаг. Подготовить рабочие места. На каждом рабочем месте приема
и выдачи лекарственного препарата установите компьютер, сканер для считывания
двухмерного штрихкода. Также понадобится УКЭП на сотрудников с правом подписи
в отчетных документах и программа для работы с ней.
11
Шаг. Обучить сотрудников. Обучите сотрудников алгоритму передачи
данных об обороте лекарств в систему маркировки.тах и программа для работы
с ней.
Алгоритм разработал Евгений Князев, эксперт ФГБУ «Национальный институт каче-
ства» Росздравнадзора, генеральный директор ООО «ЭкспертЗдравСервис», руководитель
проектов АНО ДПО «Международная медицинская школа»
75

Медицинская экспертиза и управление качеством
Приложение 2
Алгоритмы для персонала по подключению к системе
маркировки
Блок-схема 1. Подготовка и регистрация в ИС «Маркировка»
Подготовка к работе в ИС «Маркировка»
Создать рабочую группу, обозначить ответственных лиц
за организационные и технические вопросы. Создать приказ
по учреждению
Ознакомить с нормативной документацией
Изучить схемы работы с ИС «Маркировка»
Определить способ передачи данных в ИС «Маркировка»:
- Личный кабинет в ИС «Маркировка»
- Передача данных через Универсальную систему обмена (УСО)
- Передача данных с помощью аппаратно-программного
интерфейса (API)
Определить программный продукт для учета
Подготовить рабочее место сотрудника аптеки:
- Компьютер
- Сканер для считывания двухмерного штрихкода
- Квалифицированная электронная подпись
- Программное обеспечение, обеспечивающее работу
с электронной подписью лекарственных препаратов
Регистрация в ИС «Маркировка»
Установить на рабочем месте сертификат ключа проверки
электронной подписи, программы, обеспечивающие работу
с электронной подписью и защиту информации
Пройти настройку ЭЦП и программ, обеспечивающих защиту
информации на информационном ресурсе
Пройти регистрацию в ИС «Маркировка»
Получить подтверждение о регистрации, логин и пароль
76
Заместитель главного врача
№7, июль 2019 года
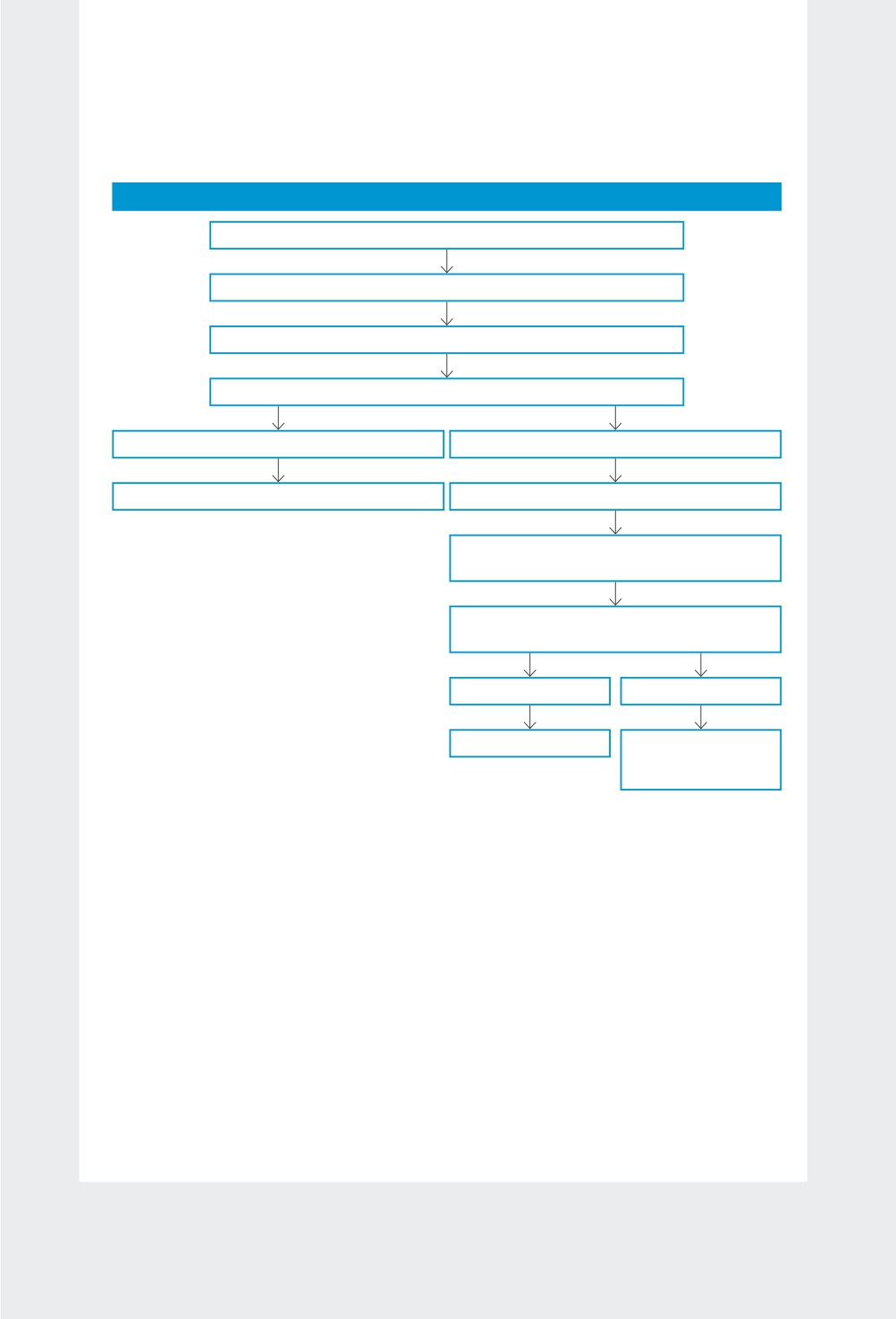
Блок-схема 2. Работа в ИС «Маркировка»
Работа в ИС «Маркировка»
Организовать закупку ЛП
Получить ЛП
В ИС «Маркировка» передать информацию о полученном ЛП
Получить результат проверки ЛП в ИС «Маркировка»
Проверку не прошел
Проверку прошел
Возврат ЛП поставщику
Выдать ЛП в отделение больницы
Передать в ИС «Маркировка» информацию
о выдаче ЛП в отделение
Получить результат проверки ЛП
в ИС «Маркировка»
Проверку не прошел
Проверку прошел
Возврат поставщику
Вывод
ЛП из оборота
в ИС «Маркировка»
77
Медицинская экспертиза и управление качеством
Приложение 3
Перечень нормативных актов по маркировке
1
Федеральный закон от 28.12.2017 № 425-ФЗ «О внесении изменений в Фе-
деральный закон “Об обращении лекарственных средств”».
2
Постановление Правительства от 24.01.2017 № 62 «О проведении экспери-
мента по маркировке контрольными (идентификационными) знаками
и мониторингу за оборотом отдельных видов лекарственных препаратов
для медицинского применения».
3
Постановление Правительства от 28.08.2018 № 1018 «О внесении измене-
ний в постановление Правительства Российской Федерации от 24.01.2017
№ 62».
4
Распоряжение Правительства от 28.04.2018 № 791-р «Об утверждении
модели функционирования системы маркировки товаров средствами
идентификации в РФ».
5
Приказ Минздрава от 13.10.2017 № 800н «Об утверждении Порядка марки-
ровки первичной и вторичной упаковки аутологичных биомедицинских
клеточных продуктов и комбинированных биомедицинских клеточных
продуктов с использованием методов радиочастотной идентификации
принадлежности такого биомедицинского клеточного продукта конкрет-
ному пациенту».
6
Методические рекомендации для проведения эксперимента по марки-
ровке контрольными (идентификационными) знаками и мониторингу
за оборотом отдельных видов лекарственных препаратов для медицин-
ского применения, находящихся в гражданском обороте на территории
Российской Федерации от 23.04.2018.
7
Постановление Правительства от 14.12.2018 № 1556 «Об утверждении по-
ложения о системе мониторинга движения лекарственных препаратов
для медицинского применения».
8
Постановление Правительства от 14.12.2018 № 1557 «Об особенностях
внедрения системы мониторинга движения лекарственных препаратов
для медицинского применения».
9
Распоряжение Правительства от 18.12.2018 № 2828-р.
10
Информационное письмо Росздравнадзора от 25.05.2018 № 04И-1304/18 «О про-
ведении обучения центров компетенций из числа лечебных учреждений».
11
Информационное письмо Росздравнадзора от 20.05.2019 № 01и-1269/19 «О со-
блюдении действующего законодательства».
78
Заместитель главного врача
№7, июль 2019 года
Приложение 4
Государственное бюджетное учреждение здравоохранения
«Городская клиническая больница» (ГБУЗ «ГКБ»)
Приказ
19.03.2019
№ 555
О внедрении системы мониторинга движения
лекарственных средств
В соответствии с постановлением Правительства Российской Феде-
рации от 24.01.2017 № 62 «О проведении эксперимента по маркировке
контрольными (идентификационными) знаками и мониторингу за обо-
ротом отдельных видов лекарственных препаратов для медицинского
применения, находящихся в гражданском обороте на территории РФ»
и Методическими рекомендациями для проведения эксперимента по мар-
кировке контрольными (идентификационными) знаками и мониторингу
за оборотом отдельных видов лекарственных препаратов для медицин-
ского применения, находящихся в гражданском обороте на территории
Российской Федерации от 23.04.2018,
ПРИКАЗЫВАЮ:
1. Принять к исполнению Методические рекомендации для проведения
эксперимента по маркировке контрольными (идентификационными)
знаками и мониторингу за оборотом отдельных видов лекарственных
препаратов для медицинского применения, находящихся в гражданском
обороте на территории Российской Федерации от 23.04.2018 (приложение 1).
2. Назначить ответственным за организационные вопросы и взаимо-
действие с Федеральной службой по надзору в сфере здравоохранения
заместителя главного врача по хозяйственным вопросам Иванова И.А.
3. Назначить ответственным за технические вопросы и взаимодействие
с ООО «Оператор-ЦРПТ» Петрову И.П.
79
Медицинская экспертиза и управление качеством
4. Начальнику отдела информационных технологий Петровой И.П.:
4.1. Подать в ООО «Оператор-ЦРПТ» заявку на участие в эксперименте.
4.2. Организовать по согласованию участие в эксперименте организации,
оказывающей услуги сопровождения подсистемы «Аптека» Медицинской
информационной системы учреждения.
5. Утвердить состав рабочей группы по проведению эксперимента по мар-
кировке контрольными (идентификационными) знаками и мониторингу
за оборотом отдельных видов лекарственных препаратов для медицин-
ского применения, находящихся в гражданском обороте на территории
РФ, в больнице (приложение 2).
6. Членам рабочей группы:
6.1. Проводить заседания рабочей группы не реже 1 раза в месяц с оформ-
лением по результатам протокола заседания.
6.2. Вносить предложения по оптимизации процессов учета, движения
лекарственных средств в учреждении в соответствии с Методическими
рекомендациями.
6.3. Вносить предложения по взаимодействию с другими участниками
эксперимента.
7. Контроль исполнения настоящего приказа оставляю за собой.
Главный врач
И.В. Львов
Документ предоставила ГБУЗ «ГКБ им. М.П. Кончаловского ДЗМ»
80