Молекулярная физика и термодинамика. Тесты с ответами - 2020 год
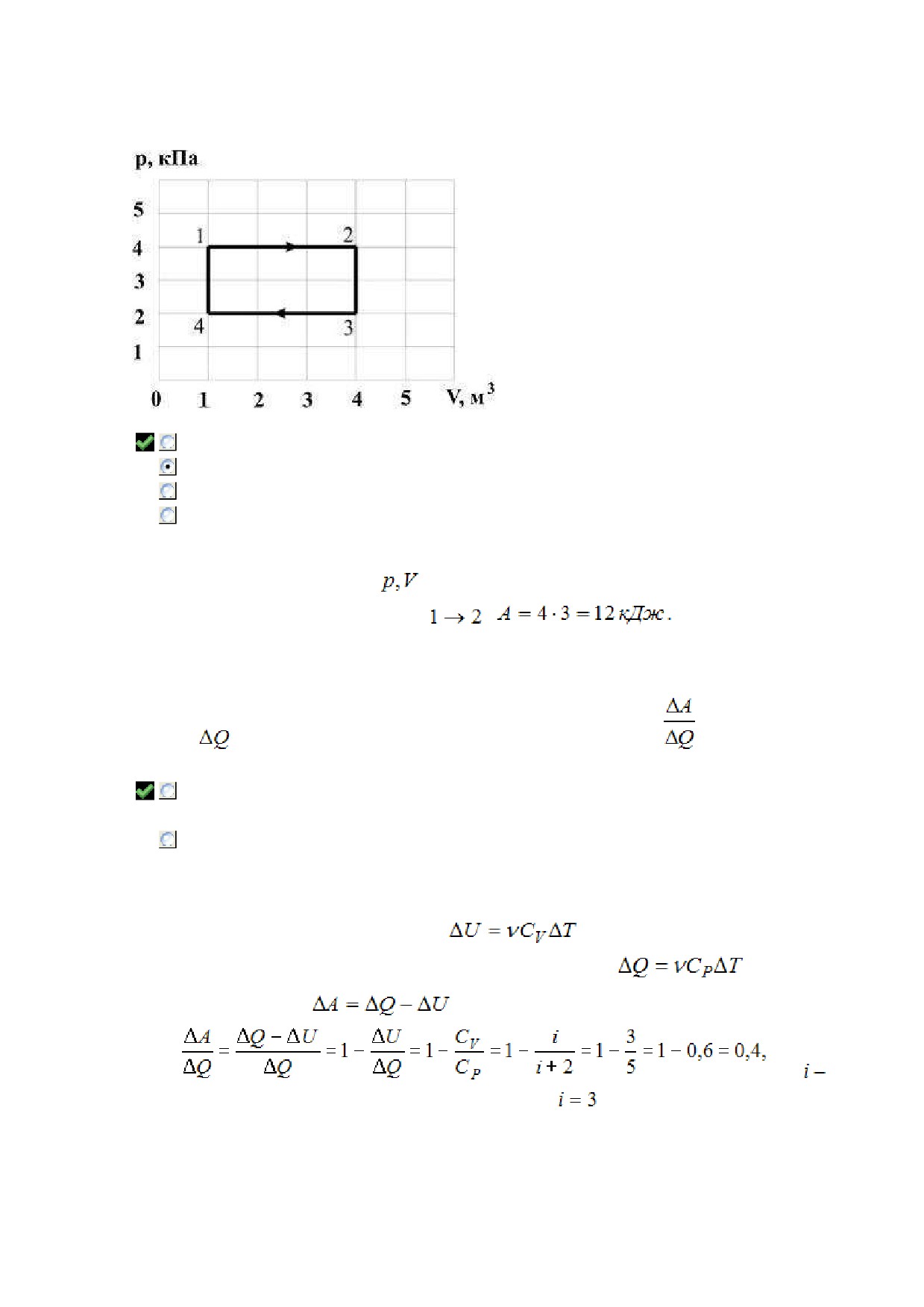
Тема: Первое начало термодинамики. Работа при изопроцессах
В процессе, представленном на рисунке, работа идеального одноатомного газа (в кДж) при
нагревании равна «
12
6
8
16
Решение:
Работа газа в координатных осях
численно равна площади под графиком функции. Работа
при нагревании совершается в процессе
Тема: Первое начало термодинамики. Работа при изопроцессах
Одноатомному идеальному газу в результате изобарического процесса подведено количество
теплоты
. На совершение газом работы расходуется часть теплоты
, равная «
0,4
0,6
0,7
0,3
Решение:
Изменение внутренней энергии газа равно
. Количество теплоты, переданное
газу при изобарическом процессе, можно определить по формуле
. Согласно I
началу термодинамики,
Тогда
где
ч
исло степеней свободы молекулы, для одноатомного газа

Тема: Первое начало термодинамики. Работа при изопроцессах
Идеальному газу сообщается одинаковое количество теплоты при изохорном (1), изобарном (2)
и изотермическом (3) процессах. Для совершаемых газом работ справедливы соотношения «
Решение:
Согласно I началу термодинамики для различных изопроцессов
имеем:
. Следовательно,
где
число степеней свободы молекулы, для одноатомного газа
Тема: Первое начало термодинамики. Работа при изопроцессах
Работа идеального одноатомного газа (в кДж) в циклическом процессе, представленном на
рисунке, равна «
120
80
200
500

Тема: Второе начало термодинамики. Энтропия
Процесс, изображенный на рисунке в координатах (T, S), где S - энтропия, является «
адиабатным сжатием
изохорным нагреванием
изобарным расширением
изотермическим расширением
Решение:
Адиабатные процессы происходят без теплообмена с окружающей средой, то есть система не
получает тепла и не отдает его,
Изменение энтропии определяется как
,
следовательно, при адиабатном процессе энтропия остается постоянной. При адиабатном
сжатии над газом совершают работу внешние силы, внутренняя энергия
увеличивается:
, температура газа увеличивается. Следовательно,
процесс
является адиабатическим сжатием.
Тема: Второе начало термодинамики. Энтропия
Процесс, изображенный на рисунке в координатах (T, S), где S - энтропия, является «
адиабатным расширением
изохорным охлаждением
изобарным сжатием
изотермическим сжатием
Решение:
Адиабатные процессы происходят без теплообмена с окружающей средой, то есть система не

получает тепла и не отдает его,
Изменение энтропии определяется как
,
следовательно, при адиабатном процессе энтропия остается постоянной. При адиабатном
расширении газ совершает работу над внешними силами, внутренняя энергия
уменьшается:
, температура газа уменьшается. Следовательно,
процесс
является адиабатным расширением.
Тема: Второе начало термодинамики. Энтропия
Если при коэффициенте полезного действия тепловой машины 80 %,
рабочее тело отдает холодильнику 200 Дж тепла, то получает от нагревателя ____ Дж тепла.
1000
1600
500
300
Решение:
Коэффициент полезного действия тепловой машины определяется по формуле
, где
- количество теплоты, полученное рабочим телом от
нагревателя;
- количество теплоты, отданное рабочим телом
холодильнику.
,
,
Тема: Второе начало термодинамики. Энтропия
При адиабатическом сжатии идеального газа «
температура возрастает, энтропия не изменяется
температура возрастает, энтропия убывает
температура и энтропия возрастают
температура не изменяется, энтропия возрастает
Решение:
Адиабатные процессы происходят без теплообмена с окружающей средой, то есть система не
получает тепла и не отдает его,
Изменение энтропии определяется как
,
следовательно, при адиабатном процессе энтропия остается постоянной. При адиабатном сжатии
над газом совершают работу внешние силы, внутренняя энергия увеличивается:
,
температура газа увеличивается.

Тема: Средняя энергия молекул
Средняя кинетическая энергия молекулы идеального газа при температуре T равна
Здесь
, где
,
и
- число степеней свободы
поступательного, вращательного и колебательного движений молекулы. При условии, что имеют
место только поступательное и вращательное движение, для водяного пара (Н2O) число i равно «
6
3
5
8
Тема: Средняя энергия молекул
В соответствии с законом равномерного распределения энергии по степеням свободы средняя
кинетическая энергия молекулы идеального газа при
температуре T равна:
Здесь
,
где
,
и
- число степеней свободы поступательного, вращательного и
колебательного движений молекулы соответственно. Для гелия (
) средняя кинетическая
энергия молекулы равна «
При комнатной температуре отношение
молярных теплоемкостей при постоянном давлении
и постоянном объеме равно для «
водяного пара
гелия
воздуха
кислорода
Решение:
Из

отношения
найдем
3 поступательные и 3 вращательные степени свободы имеют трехатомные и
многоатомные газы, следовательно, это водяной пар.
Тема: Средняя энергия молекул
Средняя кинетическая энергия молекулы идеального газа при
температуре T равна
Здесь
,
где
,
и
- число степеней свободы поступательного, вращательного и
колебательного движений молекулы. При условии, что имеют место поступательное,
вращательное и колебательное движение, для водорода (Н2) число i равно «
7
3
5
6
Решение:
Средняя кинетическая энергия молекулы равна:
где
- постоянная
Больцмана,
- термодинамическая температура,
- сумма числа поступательных, вращательных
и удвоенного числа колебательных степеней свободы молекулы:
Для молекулы водорода
число степеней свободы поступательного
движения
вращательного -
, колебательного -
,
поэтому
Тема: Средняя энергия молекул
В соответствии с законом равномерного распределения энергии по степеням свободы средняя
кинетическая энергия молекулы идеального газа при температуре T равна:
Здесь
, где
,
и
- число степеней свободы
поступательного, вращательного и колебательного движений молекулы соответственно. Для
азота
средняя кинетическая энергия колебательного движения молекулы равна «

Решение:
Для статистической системы в состоянии термодинамического равновесия на каждую
поступательную и вращательную степени свободы приходится в среднем кинетическая энергия,
равная
, а на каждую колебательную степень свободы -
. Средняя кинетическая энергия
молекулы равна:
Здесь
- сумма числа поступательных, вращательных и удвоенного числа колебательных
степеней свободы молекулы:
, где
- число степеней
свободы поступательного движения, равное 3;
- число степеней свободы вращательного
движения, которое может быть равно 0, 2, 3;
- число степеней свободы колебательного
движения, минимальное количество которых равно 1.
Для азота (
) (двухатомной молекулы)
,
и
Следовательно,
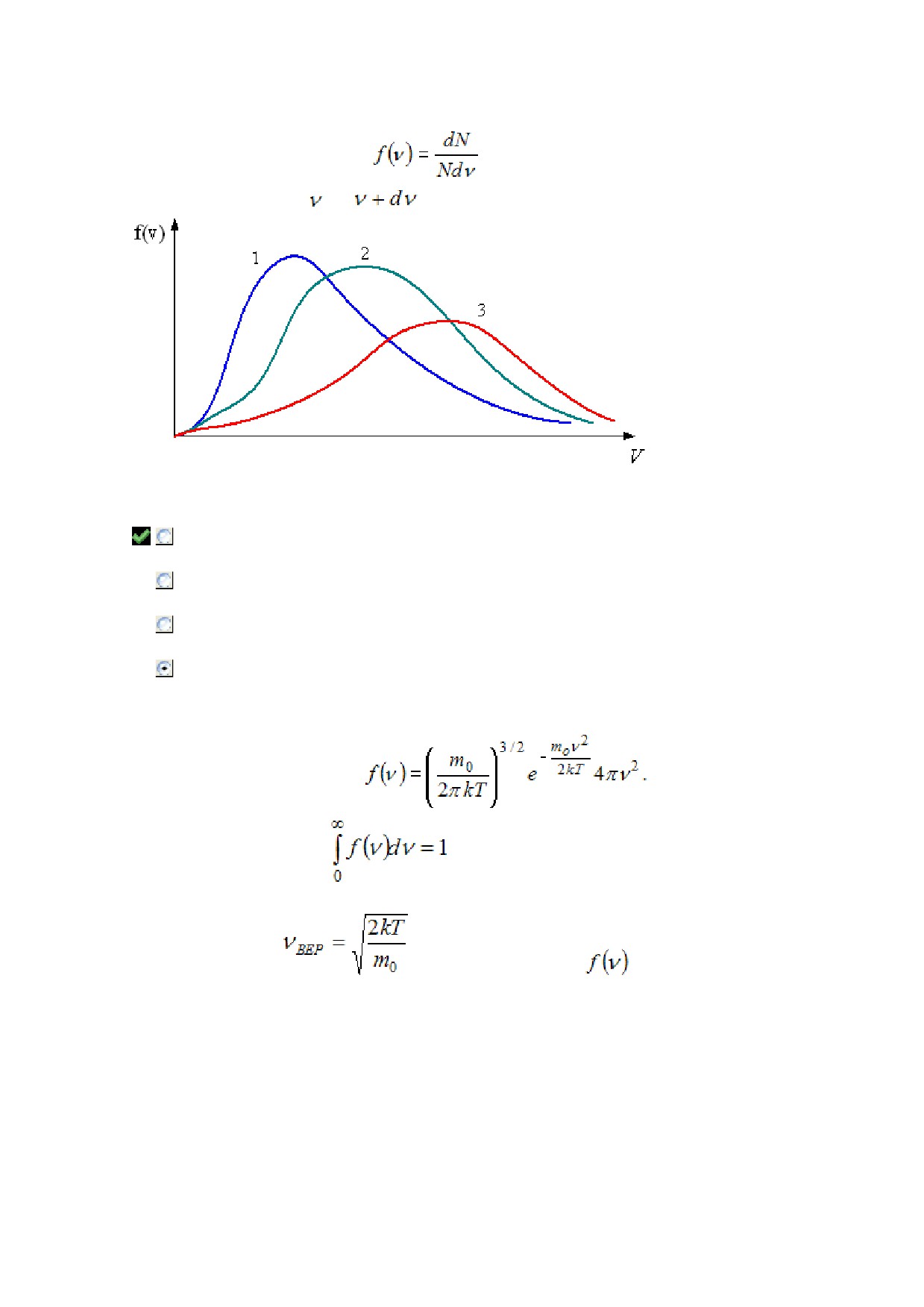
Тема: Распределения Максвелла и Больцмана
На рисунке представлены графики функции распределения молекул идеального газа по скоростям
(распределение Максвелла), где
- доля молекул, скорости которых заключены в
интервале скоростей от до
в расчете на единицу этого интервала.
Для этих функций верными являются утверждения, что «
распределение 1 соответствует газу, имеющему наибольшую массу молекул (при
одинаковой температуре)
распределение 2 соответствует газу, имеющему наибольшую температуру (при одинаковой
массе)
распределение 1 соответствует газу, имеющему наименьшую массу молекул (при
одинаковой температуре)
распределение 3 соответствует газу, имеющему наименьшую температуру (при
одинаковой массе)
Решение:
Функция Максвелла имеет вид
Полная вероятность равна:
, то есть площадь, ограниченная кривой распределения
Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее
вероятной скорости
, при которой функция
максимальна, следует, что
при повышении температуры максимум функции сместится вправо, следовательно, высота
максимума уменьшится. Если сравнивать распределения Максвелла по скоростям различных газов
при одной и той же температуре, то при увеличении массы молекулы газа максимум функции
сместится влево, следовательно, высота максимума увеличится.

Тема: Распределения Максвелла и Больцмана
Зависимости давления p идеального газа во внешнем однородном поле силы тяжести от
высоты h для двух разных температур представлены на рисунке.
Для графиков этих функций верным является утверждение, что «
температура
ниже температуры
давление газа на высоте h равно давлению на «нулевом уровне»
если
температура газа стремится к абсолютному нулю
температура
выше температуры
зависимость давления идеального газа от высоты не зависит от массы молекул
Решение:
Зависимость давления идеального газа от высоты для некоторой температуры определяется
барометрической формулой:
где
давление на высоте
,
масса молекулы,
ускорение свободного падения,
постоянная
Больцмана. Из формулы следует, что при постоянной температуре давление газа уменьшается с
высотой по экспоненциальному закону тем медленнее, чем больше температура T.
Давление
определяется весом всего газа и не меняется при изменении температуры.
Тема: Распределения Максвелла и Больцмана
На рисунке представлен график функции распределения молекул идеального газа по скоростям
(распределение Максвелла), где
- доля молекул, скорости которых заключены в
интервале скоростей от до
в расчете на единицу этого интервала.

Для этой функции верным является утверждение, что при понижении температуры «
наиболее вероятная скорость молекул уменьшается
величина максимума функции уменьшается
площадь под кривой уменьшается
максимум кривой смещается вправо
Решение:
Полная вероятность равна:
, то есть площадь, ограниченная кривой распределения
Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее
вероятной скорости
при которой функция
максимальна, следует, что при
повышении температуры максимум функции сместится вправо, следовательно, высота максимума
уменьшится.
Тема: Распределения Максвелла и Больцмана
На рисунке представлены графики зависимости концентрации молекул идеального газа n от
высоты h над уровнем моря для двух разных температур -
(распределение Больцмана).
Для графиков этих функций верным является утверждение, что «
температура
выше температуры
с понижением температуры молекулы более равномерно распределяются по высоте
температура
ниже температуры
концентрация молекул газа на «нулевом уровне»
с повышением температуры
увеличивается
Решение:
Зависимость концентрации молекул идеального газа от высоты для некоторой
температуры определяется распределением
Больцмана:
, где
концентрация молекул
на высоте
,
масса молекулы,
ускорение свободного падения,
постоянная
Больцмана. Из формулы следует, что при постоянной температуре концентрация газа больше там,
где меньше потенциальная энергия его молекул
, и уменьшается с высотой по
экспоненциальному закону тем медленнее, чем больше температура:
. С повышением
температуры из-за увеличения энергии хаотического теплового движения молекулы более
равномерно распределяются по высоте, и поэтому концентрация молекул газа на «нулевом
уровне»
уменьшается, а на высоте увеличивается