КАРДИОСТИМУЛЯТОР серии ACCOLADE, PROPONENT, ESSENTIO, ALTRUA 2. ТЕХНИЧЕСКОЕ РУКОВОДСТВО ДЛЯ ВРАЧА
ТЕХНИЧЕСКОЕ РУКОВОДСТВО ДЛЯ ВРАЧА
ACCOLADE™, ACCOLADE™ MRI,
PROPONENT™, PROPONENT™ MRI,
ESSENTIO™, ESSENTIO™ MRI,
ALTRUA™ 2,
FORMIO™, FORMIO™ MRI,
VITALIO™, VITALIO™ MRI,
INGENIO™, INGENIO™ MRI,
ADVANTIO™, ADVANTIO™ MRI
КАРДИОСТИМУЛЯТОР
REF L300, L301, L321, L310, L311, L331, L200, L201, L209, L221, L210, L211,
L231, L100, L101, L121, L110, L111, L131, S701, S702, S722, J278, J279, J272,
J273, J274, J275, J276, J277, J172, J173, J174, J175, J176, J177, J178, J062,
J063, J064, J065, J066, J067
Содержание
Дополнительная информация
1
Описание аппарата
1
Соответствующая информация
3
Показания и применение
5
Противопоказания
6
Предостережения
6
Меры предосторожности
9
Дополнительная информация о предосторожности
26
Контроль имплантируемого устройства после выполнения
терапии
26
Магнитно-резонансная томография (МРТ)
27
Минимизация конфликта кардиостимулятора с S-ICD
30
Чреcкожная электронейростимуляция (ЧЭНС)
33
Электрокаутеризация и радиочастотная (РЧ) абляция
35
Ионизирующее излучение
36
Повышенное давление
37
Возможные осложнения
40
Механические характеристики
42
Компоненты, входящие в комплект
56
Условные обозначения на упаковке
57
Заводские спецификации
61
Идентификатор, видимый с помощью рентгеновского излучения
64
Срок службы имплантируемого устройства
65
Информация о гарантии
72
Надежность продукции
72
Информация для пациента
73
Руководство для пациента
74
Соединения электродов
75
Имплантация имплантируемого устройства
79
Проверьте оборудование
79
Запросить данные с имплантируемого устройства и проверить
его
80
Имплантация системы электродов
81
Выполните базовые измерения
83
Сформируйте имплантационный «карман»
86
Подсоедините электроды к имплантируемому устройству
87
Оцените импульсы электродов
91
Выполните программирование имплантируемого
устройства
93
Имплантирование имплантируемого устройства
94
Заполните и отправьте Форму об имплантации
95
Двусторонний ключ с регулируемым торсионным моментом
96
Тестирование после завершения терапии
98
Деимплантация
101
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Дополнительные справочные данные можно найти на сайте www.bostonscientific-international.com/
manuals.
ОПИСАНИЕ АППАРАТА
В данном руководстве содержится информация об имплантируемых кардиостимуляторах серий
ACCOLADE, PROPONENT, ESSENTIO, ALTRUA 2, FORMIO, VITALIO, INGENIO, и ADVANTIO, в которые
входят следующие виды имплантируемых устройств (конкретные модели перечислены в "Механические
характеристики" на странице 42
•
SR — однокамерный кардиостимулятор, обеспечивающий желудочковую или предсердную
стимуляцию и детекцию
•
DR — двухкамерный кардиостимулятор, обеспечивающий желудочковую и предсердную
стимуляцию и восприятие
•
VDDR — двухкамерный кардиостимулятор, обеспечивающий желудочковую стимуляцию и
детекцию и предсердное восприятие
ПРИМЕЧАНИЕ: Отдельные функции, описанные в данном руководстве, могут отсутствовать в
некоторых моделях. Ссылки на названия аппаратов, несовместимых с МРТ, относятся также к
соответствующим МРТ-аппаратам. Ссылки на ICD (ИКД) включают все типы ICD (ИКД) (например,
ICD (ИКД), CRT-D, S-ICD).
Терапия
Данные имплантируемые устройства обеспечивают стимуляцию при брадикардиях и частотно-
адаптивную стимуляцию для выявления и лечения брадиаритмий.
1
Электроды
Имплантируемое устройство оснащено выходами с независимым программированием. К нему можно
подсоединить один или несколько указанных ниже электродов (в зависимости от модели):
•
Один предсердный монополярный или биполярный электрод IS-11
•
Один монополярный или биполярный электрод правого желудочка IS-1
ПРИМЕЧАНИЕ: К однокамерным аппаратам можно подсоединить либо предсердный либо
желудочковый электрод IS-1.
ПРИМЕЧАНИЕ: Использование монополярного электрода с имплантируемым устройством
ImageReady противоречит условиям использования, необходимым для МР-условно безопасного
статуса. Информацию о МРТ-сканировании см. в техническом руководстве к МР-условно безопасной
системе стимуляции ImageReady.
Имплантируемое устройство и электроды составляют имплантируемую часть системы имплантируемого
устройства.
ПРИМЕЧАНИЕ: Чтобы имплантированная система считалась МР-условно безопасной, необходимо
использовать МР-условно безопасные электроды Boston Scientific. Номера моделей имплантируемых
устройств, электродов, принадлежностей и других компонентов системы, необходимых для
выполнения условий использования, см. в техническом руководстве по МРТ.
Система ПРМ
Данные имплантируемые устройства можно использовать только вместе с программирующей системой
ZOOM LATITUDE, которая является внешней частью системы имплантируемого устройства и включает
следующее:
•
Программатор/регистратор/монитор (ПРМ) модели 3120
1.
IS-1 соответствует международному стандарту ISO 5841-3:2013.
2
•
Радиопередатчик модели 3140 ZOOM
•
Программное обеспечение ZOOMVIEW, модель 2869
•
Вспомогательная телеметрическая головка, модель 6577
Систему ПРМ можно использовать в следующих целях:
•
Опрос имплантируемого устройства
•
Программирование имплантируемого устройства на выполнение разнообразных видов терапий
•
Доступ к диагностическим функциям имплантируемого устройства
•
Выполнение неинвазивных диагностических испытаний
•
Доступ к архивным данным по видам лечения
•
Сохранение 12-секундной дорожки ЭКГ/ЭМГ, отображаемой на любом из экранов
•
Доступ к интерактивному демонстрационному режиму или режиму Patient Data (Данные пациента)
при отсутствии имплантируемого устройства
•
Распечатки данных пациента, включая терапевтические опции имплантируемого устройства и
данные истории терапии
•
Сохранения данных пациента
Вы можете программировать имплантируемое устройство двумя способами: автоматически с
использованием Indications-Based Programming (Программирования на основе показаний) или вручную.
СООТВЕТСТВУЮЩАЯ ИНФОРМАЦИЯ
Информацию об имплантации, общих предостережениях и мерах предосторожности, показаниях,
противопоказаниях и технических характеристиках см. в инструкции по использованию электродов.
Внимательно ознакомьтесь с данным материалом для получения инструкций по имплантации с учетом
выбранной конфигурации электродов.
3
Конкретную информацию об использовании ПРМ или беспроводного передатчика ZOOM Wireless
Transmitter, такую как сведения о настройке, техническом обслуживании и порядке работы с
устройствами, см. в Руководстве пользователя ПРМ или Справочном руководстве беспроводного
передатчика ZOOM Wireless Transmitter.
Информацию о МРТ см. в Техническом руководстве по МРТ и использованию МР-условно безопасной
системы стимуляции ImageReady.
LATITUDE NXT — это система дистанционного мониторинга, которая обеспечивает специалистов
данными из имплантируемого устройства. Это имплантируемое устройство совместимо с LATITUDE
NXT. Наличие зависит от региона.
LATITUDE NXT поддерживается следующими аппаратами: ACCOLADE, PROPONENT, ESSENTIO MRI,
FORMIO, VITALIO, INGENIO и ADVANTIO.
•
Врачи/специалисты — LATITUDE NXT позволяет периодически отслеживать состояние аппарата и
пациента в автоматическом и дистанционном режиме. Система LATITUDE NXT предоставляет
данные пациентов, которые можно использовать в клиническом анализе их состояния.
•
Пациенты — основным компонентом системы является коммуникатор LATITUDE, представляющий
собой простой в использовании аппарат для мониторинга в домашних условиях. Коммуникатор
автоматически считывает данные с совместимого имплантированного устройства компании Boston
Scientific в установленное врачом время. Затем он отправляет эти данные на безопасный сервер
LATITUDE NXT, используя стандартную аналоговую телефонную линию или сотовую сеть передачи
данных. Сервер LATITUDE NXT отображает данные пациента на веб-сайте LATITUDE NXT,
доступном авторизованным врачам и специалистам в Интернете.
Подробные сведения приведены в Руководстве клинициста LATITUDE NXT.
ЦЕЛЕВАЯ АУДИТОРИЯ
Эта литература предназначена для специалистов, производящих имплантацию аппарата и/или
последующие контрольные процедуры.
4
ПОКАЗАНИЯ И ПРИМЕНЕНИЕ
Кардиостимуляторы Boston Scientific показаны для лечения следующих состояний.
•
Симптоматическая преходящая или стойкая АВ-блокада второй или третьей степени
•
Симптоматическая билатеральная блокада ножек пучка Гиса
•
Симптоматическая пароксизмальная или преходящая дисфункция синусового узла с нарушениями
АВ-проводимости или без ее нарушений (т. е. синусовая брадикардия, остановка синусового узла,
синоатриальная [СА] блокада)
•
Синдром брадикардии-тахикардии — для предотвращения симптоматической брадикардии или
некоторых форм симптоматических тахиаритмий
•
Нейроваскулярный (вазовагальный) синдром или синдром гиперчувствительности каротидного
узла
Частотно-адаптирующая стимуляция показана пациентам с хронотропной некомпетентностью и
пациентам, которые могут получить хороший эффект от увеличения частоты стимуляции одновременно
с повышением минутной вентиляции и/или уровня физической активности.
Режимы двухкамерной стимуляции и отслеживания работы предсердий также показаны пациентам,
которые могут получить хороший эффект от поддержания АВ-синхронизации.
Двухкамерные режимы стимуляции специально предназначены для лечения следующих состояний:
•
Нарушения проводимости, требующие восстановления АВ-синхронизации, включая АВ-блокады
различных степеней
•
Непереносимость стимуляции в режиме VVI (т. е. синдром кардиостимулятора) при стойком
синусовом ритме
•
Низкий сердечный выброс или застойная сердечная недостаточность вследствие брадикардии
5
ПРОТИВОПОКАЗАНИЯ
Эти кардиостимуляторы Boston Scientific противопоказаны пациентам с отдельным имплантированным
кардиовертером-дефибриллятором (ICD (ИКД)) оснащенным трансвенозным электродом.
Некоторые режимы стимуляции и/или функции этих кардиостимуляторов Boston Scientific
противопоказаны следующим пациентам при указанных ниже условиях:
•
Монополярная стимуляция или использование сенсора MV (МВ) с подкожно имплантируемым
кардиовертером-дефибриллятором, поскольку это может вызывать несоответствующую терапию
или приостановку соответствующей терапии S-ICD.
•
Minute Ventilation (Минутная вентиляция) у пациентов с монополярным предсердным и
желудочковым электродами
•
Однокамерная предсердная стимуляция у пациентов с нарушенной узловой АВ-проводимостью
•
Режимы отслеживания состояния предсердий у пациентов с хроническими рефракторными
предсердными тахиаритмиями (фибрилляцией или трепетанием предсердий), что может вызвать
желудочковую стимуляцию
•
Двухкамерная и однокамерная стимуляция предсердий у пациентов с хроническими
рефракторными предсердными тахиаритмиями
•
Асинхронная стимуляция при наличии (или вероятности) конкуренции между стимулированным и
собственным ритмом пациента
ПРЕДОСТЕРЕЖЕНИЯ
Общие сведения
•
Знание инструкций по применению. Во избежание повреждения имплантируемого устройства и/
или электрода внимательно ознакомьтесь с данным руководством до имплантации. Подобное
повреждение может привести к нанесению вреда пациенту или смерти.
6
•
Для использования только у одного пациента. Повторно не использовать, не обрабатывать и не
стерилизовать. Повторное использование, обработка или стерилизация могут нарушить
целостность структуры аппарата и/или вывести аппарат из строя, что, в свою очередь, может
привести к нанесению вреда, заболеванию или смерти пациента. Повторное использование,
обработка или стерилизация могут также создать угрозу загрязнения аппарата и/или вызвать
инфекцию у пациента, или перекрестную инфекцию, в том числе передачу инфекционного
заболевания от одного пациента к другому. Загрязнение аппарата может привести к нанесению
вреда, болезни или смерти пациента.
•
Резервная дефибрилляция. При проведении имплантации и электрофизиологического
исследования в вашем распоряжении всегда должен быть наружный дефибриллятор. Если
индуцированную желудочковую тахиаритмию не купировать вовремя, это может привести к смерти
пациента.
•
Сочетания электродов для МРТ. Оценка совместного использования электродов FINELINE II и
INGEVITY MRI с МР-условно безопасным имплантируемым устройством Boston Scientific не
проводилась. Сочетание этих компонентов не является МР-условно безопасной системой
стимуляции ImageReady.
•
Отдельное имплантируемое устройство. Использование нескольких имплантируемых устройств
может вызвать взаимодействие имплантируемых устройств, которое может повлечь за собой
причинение вреда пациенту или невыполнение терапии. Каждую систему нужно тестировать
индивидуально и в сочетаниях во избежание нежелательных взаимодействий ("Минимизация
конфликта кардиостимулятора с S-ICD" на странице 30)
•
Работа в режиме Safety Core. В ответ на повторяющиеся аварийные ситуации или невозможность
восстановления нормального функционирования имплантируемое устройство необратимо
переключится на работу в режиме Safety Core. Стимуляция в режиме Safety Core может быть
монополярной, что может вызвать взаимодействие с ICD (ИКД) ("Минимизация конфликта
кардиостимулятора с S-ICD" на странице 30). На работу в режиме Safety Core влияет MRI Protection
Mode (Режим защиты при МРТ). См. "Магнитно-резонансная томография (МРТ)" на странице 27.
7
Обращение
•
Не перегибайте электроды. Не скручивайте, не сгибайте электрод и не обвивайте его другими
электродами, поскольку это может привести к абразивному повреждению изоляции электрода или
повреждению проводника.
Программирование и работа аппарата
•
Режимы стимуляции желудочков, синхронизируемой с предсердной активностью. У
пациентов с хроническими рефрактерными предсердными тахиаритмиями не используйте режимы,
при которых стимуляция желудочков синхронизируется с предсердной активностью. Подобная
стимуляция при предсердных аритмиях может привести к желудочковой тахиаритмии.
•
Предохранительный выключатель электрода. Lead Safety Switch (Предохранительный
выключатель электрода) для пациентов с ICD (ИКД) следует запрограммировать на выключенное
состояние (Off). Монополярная стимуляция вследствие применения функции Lead Safety Switch
(Предохранительный выключатель электрода) противопоказана для пациентов с ICD (ИКД).
•
Тестирование RAAT. Монополярная стимуляция вследствие применения функции RAAT
(Автоматического определения порога для правого предсердия) противопоказана для пациентов с
ICD (ИКД). Функция RAAT (Автоматического определения порога для правого предсердия)
выполняет автоматическое тестирование пороговых значений в конфигурации монополярной
стимуляции.
•
Настройки чувствительности и ЭМИ. При установке фиксированного значения Sensitivity
(Чувствительность) предсердий на 0,15 мВ или при установке фиксированного значения
чувствительности, равной 2,0 мВ или менее в монополярной конфигурации в любой из камер
имплантируемое устройство может быть больше подвержено влиянию электромагнитных помех.
Такая повышенная уязвимость должна приниматься в расчет при определении графика
контрольных посещений врача для пациентов, которым требуется подобная настройка.
8
После имплантации
•
Охранительный режим после операции. Посоветуйте своим пациентам ознакомиться с
медицинскими рекомендациями относительно нахождения в среде, которая может отрицательно
воздействовать на работу действующего аппарата, включая зоны с предупредительными знаками,
запрещающими вход в них пациентов с имплантируемым устройством.
•
Воздействие магнитно-резонансной томографии (МРТ). Если не соблюдены все условия
использования МРТ, МРТ-сканирование пациента не будет соответствовать МР-условно
безопасным требованиям для имплантированной системы, в результате чего возможно причинение
пациенту значительного вреда, или смерть пациента, и/или повреждение имплантированной
системы.
Возможные осложнения при соблюдении или несоблюдении условий использования приведены в
техническом руководстве по МРТ. "Магнитно-резонансная томография (МРТ)" на странице 27
содержит дополнительные предостережения, меры предосторожности и условия использования,
касающиеся МРТ-сканирования.
•
Диатермия. Пациентам с имплантированным устройством и/или электродом нельзя проводить
диатермию, поскольку диатермия может вызвать фибрилляцию, ожог миокарда и необратимое
повреждение имплантируемого устройства из-за возникновения индуцированных токов.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Клинические соображения
•
STAT PACE (СТАТИЧЕСКАЯ СТИМУЛЯЦИЯ). STAT PACE (Программа статической стимуляции)
начинает монополярную стимуляцию. Монополярная стимуляция STAT PACE (Статическая
стимуляция) может привести к ненадлежащей терапии или к приостановке надлежащей терапии с
помощью S-ICD.
9
•
Опосредованная кардиостимулятором тахикардия (PMT). Установка для параметра PVARP
минимального значения ниже ретроградного V-A, может увеличить вероятность наступления
состояния PMT (опосредованной кардиостимулятором тахикардии).
•
Автоматический захват. Функция «Automatic Capture» (Автоматический захват) предназначена
только для желудочка. При имплантации однокамерных аппаратов с точкой приложения стимуляции
в предсердии нельзя устанавливать для параметра Amplitude (Амплитуда) значение Auto (Авто).
•
Режимы стимуляции с сенсором минутной вентиляции (МВ). Безопасность и эффективность
сенсора МВ у пациентов с абдоминальной локализацией аппарата не подтверждена клиническими
данными.
•
Эффективность режима с сенсором минутной вентиляции (МВ). На работу сенсора МВ могут
отрицательно влиять такие транзиторные состояния, как пневмоторакс, перикардиальный или
плевральный выпот. Рекомендуется устанавливать значение Off (Выкл.) для сенсора МВ до
разрешения данных состояний.
•
Режимы с частотной адаптацией. Режимы с частотной адаптацией, полностью или частично
основанные на МВ, могут не подходить пациентам, которые могут достичь дыхательных циклов
короче одной секунды (более 60 вдохов в минуту). Более высокая частота дыхания ослабляет
сигнал импеданса, который снижает частотный ответ на МВ (т.е. частота стимуляции будет
снижаться к запрограммированной Нижней Границе Частоты Стимуляции/Нижний предел частоты).
Режимы с частотной адаптацией, полностью или частично основанные на МВ, не рекомендуется
использовать у пациентов с:
•
ICD (ИКД)
•
Монополярными электродами — для детекции МВ требуется наличие биполярного электрода
в предсердии или желудочке
•
Электродом, который не является биполярным трансвенозным — измерение МВ было
протестировано только с использованием биполярного трансвенозного электрода
10
•
Механическим вентилятором — использование вентилятора может привести к неадекватной
частоте, управляемой сенсором МВ
Стерилизация и хранение
•
При повреждении упаковки. Блистерные лотки и их содержимое перед окончательной упаковкой
стерилизованы оксидом этилена. При поступлении имплантируемого устройства и/или электрода
они являются стерильными при условии, что упаковка не повреждена. Если упаковка намокла,
проколота, вскрыта или каким-либо иным образом повреждена, верните имплантируемое
устройство и/или электрод в Boston Scientific.
•
В случае падения аппарата. Не имплантируйте аппарат, который выпадал из вскрытой защитной
упаковки. Не имплантируйте аппарат, который падал с высоты более 61 см (24 дюйма), находясь
внутри защитной упаковки. В данных условиях невозможно гарантировать стерильность, цельность
или функциональность аппарата, он должен быть возвращен Boston Scientific на проверку.
•
Температура хранения, соблюдение температурных условий. Рекомендованный диапазон
температур для хранения - от 0 °C до 50 °C (от 32 °F до 122 °F). Перед выполнением телеметрии,
программирования или имплантации устройства необходимо дать возможность аппарату достичь
надлежащей температуры, поскольку экстремальные температурные значения могут повлиять на
работу аппарата.
•
Хранение аппарата. Чтобы избежать повреждения аппарата, храните имплантируемое устройство
в чистом месте вдали от магнитов, наборов с магнитами и источников ЭМП.
•
Использовать до. Выполняйте имплантацию имплантируемого устройства и/или электрода до
истечения даты ИСПОЛЬЗОВАТЬ ДО, указанной на упаковке, или непосредственно в данный день,
поскольку эта дата является утвержденным сроком годности при хранении. Например, если
указанная на упаковке дата - 1 января, имплантировать устройство 2 января или позднее нельзя.
11
Имплантация
•
Предполагаемые преимущества. Необходимо определить, перевешивает ли ожидаемый эффект
от использования программируемых опций вероятность более быстрого истощения батареи.
•
Оценить готовность пациента к операции. Пациент может считаться неподходящим кандидатом
для имплантации данной системы при наличии дополнительных факторов, касающихся его общего
состояния здоровья и медицинского состояния, которые не имеют прямого отношения к
функционированию аппарата или цели имплантации. Общественные организации по защите
сердечного здоровья, возможно, опубликовали рекомендации, которые могут оказаться полезными
при проведении такой оценки.
•
Совместимость электродов. Перед имплантацией убедитесь в совместимости электрода и
имплантируемого устройства. Использование несовместимых электродов и имплантируемых
устройств может повредить коннектор и/или привести к возможным неблагоприятным
последствиям, таким как недостаточное восприятие сердечных сигналов или невозможность
проведения необходимой терапии.
•
Телеметрическая головка. На случай сбоя телеметрической связи ZIP, обеспечьте наличие
стерильной телеметрической головки. Удостоверьтесь в том, что головка легко подключается к
программатору и находится в пределах досягаемости имплантируемого устройства.
•
Оборудование с питанием от сети. Будьте предельно осторожны при тестировании электродов с
использованием оборудования, питающегося от сети, поскольку утечка тока более 10 мкА может
привести к развитию фибрилляции желудочков. Убедитесь, что все используемое оборудование с
питанием от сети, соответствует спецификациям.
•
Замещающий аппарат. Имплантация замещающего аппарата в подкожный карман имплантации,
где раньше находился более крупный аппарат, может привести к попаданию воздуха в карман,
миграции устройства, эрозии или недостаточному заземлению между аппаратом и тканью.
Орошение ложа стерильным физиологическим раствором снижает вероятность попадания в него
12
воздуха и недостаточное заземление. Подшивание аппарата снижает вероятность миграции и
эрозии.
•
Не перегибайте электрод возле соединения электрода с головкой. Введите концевую часть
электрода непосредственно в порт для электрода. Не перегибайте электрод возле соединения
электрода с головкой. Неправильное введение электрода может привести к повреждению его
изоляции или коннектора.
•
Отсутствие электрода. Отсутствие электрода или заглушки в порте для электрода может повлиять
на работу аппарата. Если электрод не используется, должным образом вставьте в неиспользуемый
порт заглушку, а затем затяните фиксирующий винт на заглушке.
•
Двухкамерный аппарат без функционального электрода RV (ПЖ). Если режим работы
двухкамерного аппарата установлен на AAI(R), убедитесь в наличии функционирующего электрода
RV (ПЖ). При отсутствии функционирующего электрода RV (ПЖ) установка режима работы на AAI
(R) может привести к недостаточной или избыточной детекции.
•
Соединения полюсов. Для правильного введения электрода в коннектор имплантируемого
устройства соблюдайте следующие меры предосторожности.
•
Для выпускания скопившейся жидкости или воздуха вставьте отвертку в щелевое углубление
уплотняющей заглушки перед тем, как вставить электрод в порт.
•
Убедитесь, что фиксирующий винт достаточно выкручен, чтобы вставить электрод. При
необходимости ослабьте винт при помощи отвертки.
•
Полностью введите электрод в порт, а затем закрутите фиксирующий винт на концевом штыре
электрода.
•
Не накладывайте швы непосредственно поверх электрода. Не накладывайте швы
непосредственно над телом электрода. Это может привести к его повреждению. Чтобы
предотвратить смещение электрода, используйте фиксирующую муфту, чтобы закрепить электрод
проксимальнее места входа в вену.
13
•
Сенсор МВ. Не устанавливайте для параметра сенсора MV (МВ) значение On (Вкл) до тех пор, пока
устройство не будет имплантировано, а целостность системы не будет протестирована и
подтверждена.
Программирование аппарата
•
Связь с аппаратом. Используйте только специальный программатор и программное обеспечение
для связи с имплантируемым устройством.
•
Настройки STAT PACE (Статическая стимуляция). Когда имплантируемое устройство
запрограммировано на параметры программы STAT PACE (Статическая стимуляция), оно будет
продолжать стимуляцию с высокоэнергетическими значениями программы STAT PACE
(Статическая стимуляция), если настройки не были изменены. Использование параметров STAT
PACE (Статическая стимуляция), вероятнее всего, уменьшит срок службы аппарата.
•
Пороги стимуляции и восприятия. При выборе значений параметра Pacing Amplitude (Амплитуда
стимуляции), параметра Pulse Width (Ширина импульса) стимуляции и параметра Sensitivity
(Чувствительность) учитывайте фактор образования соединительно-тканной капсулы вокруг
электрода.
•
Значение Pacing Threshold (Порог стимуляции) острой стимуляции выше 1,5 В или значение
Pacing Threshold (Порог стимуляции) хронической стимуляции выше 3 В может привести к
потере захвата, поскольку пороги с течением времени могут расти.
•
При значении параметра R-Wave Amplitude (Амплитуда зубца R) менее 5 мВ или параметра P-
Wave Amplitude (Амплитуда зубца P) менее 2 мВ вероятно недостаточное восприятие
сигналов, поскольку амплитуда воспринимаемого сигнала может снижаться после
имплантации.
•
Параметр Pacing Lead Impedance (Импеданс стимулирующего электрода) должен быть
больше установленного значения Low (Нижнего предельного значения) импеданса и меньше
2000 ом или запрограммированного значения High (Верхнего предельного значения)
импеданса).
14
•
Значения импеданса и переключатель безопасности электрода. Если используются исправные
электроды со стабильными измеряемыми значениями импеданса, которые близки к
запрограммированным предельным значениям, следует рассмотреть возможность установки для
параметра Lead Safety Switch (Переключатель безопасности электрода) значения Off (Выкл) или
возможность изменения предельных значений импеданса во избежание нежелательного
переключения на монополярную конфигурацию электрода (Unipolar Lead Configuration).
•
Правильное программирование конфигурации электродов. Если параметр Lead Configuration
(Конфигурация электрода) запрограммирован на значение Bipolar (Биполярный) при установленном
монополярном электроде, стимуляция выполняться не будет.
•
Программирование для наджелудочковых тахиаритмий (НЖТ). Определите, подходят ли
аппарат и программируемые опции для пациентов с НЖТ, поскольку НЖТ могут инициировать
проведение нежелательной терапии.
•
Частотно-адаптивная стимуляция. Параметр Rate Adaptive Pacing (Частотно-адаптивная
стимуляция) следует использовать с осторожностью у пациентов, которые не могут переносить
повышенную частоту стимуляции.
•
Желудочковые рефракторные периоды (ЖРП) при стимуляции с частотной адаптацией.
Частотно-адаптирующая стимуляция не ограничивается рефрактерными периодами. Длинный
рефракторный период, запрограммированный в сочетании с высокой частотой MSR (Максимальная
сенсорная частота), может привести к асинхронной стимуляции во время рефракторных периодов,
поскольку такое сочетание может стать причиной очень маленького окна восприятия или его
полного отсутствия. Используйте функцию Dynamic AV Delay (Динамическая AV-задержка) или
Dynamic PVARP (Динамический PVARP) для оптимизации окон восприятия. При программировании
фиксированного значения AV Delay (AV-задержка) следует учитывать результаты восприятия.
•
Программирование максимальной частоты отслеживания/сглаживания. Максимальная
частота отслеживания и максимальная частота сенсора имплантируемого устройства должны быть
15
запрограммированы на частоту, которая ниже сопутствующей минимальной частоты определения
тахикардии аппаратом S-ICD.
•
Избыточное восприятие предсердных сигналов. Следите за тем, чтобы артефакты, исходящие
из желудочков, отсутствовали на предсердном канале, в противном случае может произойти
излишнее восприятие предсердных сигналов (oversensing). Если желудочковые артефакты все же
присутствуют на предсердном канале, возможно, необходимо изменить положение предсердного
электрода, чтобы свести к минимуму это взаимодействие.
•
Счетчик входа в ATR. Будьте осторожны при программировании низких значений параметра Entry
Count (Счетчик входа) в сочетании с коротким значением параметра ATR Duration (Длительность
ATR). Данная комбинация позволяет переключать режим стимуляции в ответ на восприятие очень
маленького количества частых предсердных сокращений. Например, если значение Entry Count
(Счетчик входа) было установлено на 2, а значение параметра ATR Duration (Длительность ATR) —
на 0, переключение режима ATR может произойти при двух частых предсердных интервалах. В
подобных случаях короткая серия предсердных экстрасистол может вызвать переключение режима
стимуляции аппарата.
•
Счетчик выхода из ATR. Будьте осторожны при программировании низких значений Exit Count
(Счетчик выхода). Например, если значение Exit Count (Счетчик выхода) установлено на 2,
несколько циклов с невоспринятыми предсердными событиями могут привести к отмене
переключения режима стимуляции.
•
Правильное программирование без предсердного электрода. Если предсердный электрод не
имплантировался (порт заглушен) или если предсердный электрод не используется, но остается
подсоединенным к головке, программирование аппарата должно выполняться в соответствии с
количеством и типом фактически используемых электродов.
•
Предсердное восприятие запрограммировано на выключение. Если в режиме DDI(R) или DDD
(R) для предсердного восприятия запрограммировано значение Off (Выкл.), любая выполняемая
16
предсердная стимуляция будет асинхронной. Кроме того, функции, требующие предсердного
восприятия, могут функционировать непредсказуемо.
•
Высокие предсердные частоты. Восприятие высокий предсердных частот может сказаться на
длительности срока службы аппарата. Следовательно, при программировании перехода от
предсердного восприятия к режиму непредсердного восприятия, конфигурация предсердного
воспринимающего электрода Sense будет установлена на значение Off (Выкл.).
•
Перекрестно-камерные артефакты. Средства коррекции чувствительности, ассоциированные со
SmartBlanking, могут быть недостаточными для того, чтобы блокировать перекрестно-камерные
искажения, если эти артефакты слишком велики. Оцените другие факторы, которые влияют на
размер/амплитуду перекрестно-камерных искажений, включая размещение электрода, выходной
сигнал стимуляции и запрограммированные настройки Sensitivity (Чувствительности).
•
Артефакты сигнала сенсора. Если на электрограммах наблюдаются артефакты сигнала сенсора
МВ, а электроды в остальном работают нормально, попробуйте установить сенсор в положение Off
(Выкл.), чтобы предотвратить чрезмерное восприятие.
•
Однопроходные электроды VDD. При использовании однопроходного электрода VDD с
двухкамерным аппаратом предсердные полюса могут не соприкасаться со стенкой предсердия. В
таком случае измеренный сигнал деполяризации имеет относительно малую амплитуду и может
потребоваться увеличение настройки чувствительности.
•
Рекалибровка МВ. Для получения точного исходного уровня МВ сенсор МВ будет откалиброван
автоматически или может быть откалиброван вручную. Новая калибровка вручную должна
выполняться при удалении имплантируемого устройства из его кармана после имплантации в таких
ситуациях, как, например, репозиция электрода или в случаях, когда исходный уровень МВ может
быть подвержен влиянию таких факторов, как образование соединительно-тканой капсулы,
попадание воздуха в карман, смещение имплантируемого устройства вследствие слабого
наложения швов, внешняя дефибрилляция или кардиоверсия или иные осложнения у пациента
(например, пневмоторакс).
17
•
Регулировка чувствительности. После любой регулировки параметра Sensitivity
(Чувствительность) или любой модификации воспринимающего электрода всегда проверяйте
адекватность восприятия сигналов. Программирование параметра Sensitivity (Чувствительность) на
самое высокое значение (самая низкая чувствительность) может привести к задержке обнаружения
тахикардии или недовосприятию (undersensing) сердечной активности. Аналогичным образом,
минимальное значение чувствительности (максимальная чувствительность) может привести к
избыточному восприятию сигналов, идущих не от сердца.
•
Чувствительность при монополярной конфигурации электрода. Амплитуда и преобладание
миопотенциальных сигналов увеличивается в монополярных конфигурациях электродов в
сравнении с биполярными конфигурациями. У пациентов с монополярной конфигурацией
электродов и миопотенциальной гипердетекцией в период активности с участием пекторальных
мышц рекомендуется программирование параметра Fixed Sensitivity (Фиксированная
чувствительность).
•
Использование монитора, активируемого пациентом. При активации функции Patient Triggered
Monitor (Монитор, активированный пациентом) соблюдайте осторожность, поскольку при ее
включении происходит следующее:
•
Все остальные функции магнита будут выключены, включая асинхронную стимуляцию.
Функция Magnet (Магнит) не будет показывать положение магнита.
•
Данные манипуляции влияют на срок службы аппарата. Чтобы сократить влияние данной
функции на срок службы аппарата, монитор, активированный пациентом, допускает
сохранение только одного эпизода и автоматически выключается через 60 дней, если
сохранение данных не запускалось.
•
После сохранения ЭГМ (или истечения 60-дневного периода) PTM (Монитор, активированный
пациентом) выключается, а Magnet Response (Реакция аппарата на магнит) автоматически
устанавливается на Pace Async (Асинхронную стимуляцию). Однако при использовании
18
магнита имплантируемое устройство не начнет работать асинхронно до удаления магнита на 3
секунды и его повторного наложения на аппарат.
Опасности, связанные с окружающей средой и различными лекарственными терапиями
•
Избегайте электромагнитных помех (ЭМП). Рекомендуйте пациентам избегать источников
электромагнитных помех. В присутствии ЭМП имплантируемое устройство может блокировать
стимуляцию вследствие гипердетекции или же может переключиться на асинхронную стимуляцию с
запрограммированной частотой стимуляции или частотой магнита.
Удаление из зоны действия источника ЭМП или отключение такого источника обычно позволяет
имплантируемому устройству вернуться к обычному режиму работы.
Примеры потенциальных источников ЭМП:
•
Источники электроснабжения, оборудование для электродуговой или контактной сварки,
робототехнические приспособления
•
Bысоковольтные линии электропередач
•
Электроплавильные печи
•
Крупные РЧ-передатчики, такие как радар
•
Pадиопередатчики, включая используемые в игрушках
•
Средства электронной защиты (против кражи)
•
Генератор переменного тока работающего автомобиля
•
Медицинские процедуры и диагностические исследования, в ходе которых через тело
пропускается электрический ток, такие как ЧЭНС, электрокаутеризация, электролиз/термолиз,
электродиагностическое исследование, электромиография или исследования проводимости
нервов
19
•
Любой наружный рабочий аппарат, использующий аварийную систему автоматической
детекции электрода (например, аппарат ЭКГ)
•
Радиочастотное и телекоммуникационное терминальное оборудование (RTTE). Компания
Boston Scientific настоящим заявляет, что данный аппарат соответствует основным требованиям и
другим соответствующим положениям Директивы 1999/5/EC. За полным текстом заявления о
соответствии обращайтесь в Boston Scientific — контактная информация указана на последней
странице обложки.
ПРИМЕЧАНИЕ: Как и при использовании любого другого телекоммуникационного
оборудования, необходимо учитывать требования государственного законодательства о
неприкосновенности частной информационной собственности.
Больничное оборудование и медицинские приборы
•
Искусственная вентиляция легких. Во время искусственной вентиляции установите сенсор MV
(МВ) в положение Off (Выкл). В противном случае может произойти следующее:
•
Неадекватная частота ритма, задаваемая сенсором МВ
•
Неправильное построение трендов на основе дыхания
•
Проведенный электрический ток. Любое медицинское оборудование, процедура, терапия или
диагностическое исследование, в ходе которого через пациента пропускается электрический ток,
имеет вероятность создания помех при работе имплантируемого устройства.
•
Наружные мониторы пациента (например, дыхательные мониторы, мониторы поверхностной
ЭКГ, гемодинамические мониторы) могут воздействовать на диагностические функции
имплантируемого устройства, при выполнении которых используется значение сопротивления
(например, построение тренда Respiratory Rate (Частота дыхания). Помимо этого, такое
воздействие может приводить к ускорению стимуляции до максимальной частоты, задаваемой
сенсором, если сенсор MV (МВ) находится в положении On (Вкл). Для прекращения
предполагаемого взаимодействия с сенсором MV (МВ) следует выключить сенсор,
20
запрограммировав для него значение Off (Выкл) (сенсор перестает задавать частоту МВ и
строить тренды МВ) или значение Passive (Пассивный режим) (сенсор перестанет задавать
частоту МВ). В качестве альтернативы можно запрограммировать параметр Brady Mode
(Режим брадикардии) так, чтобы в этом режиме не воспринималась частота, вследствие чего
сенсор перестанет задавать частоту МВ. Если ПРМ недоступен, а имплантируемое устройство
проводит стимуляцию с частотой, заданной сенсором, наложите магнит на имплантируемое
устройство, чтобы инициировать временную асинхронную стимуляцию, невосприимчивую к
частоте.
•
Медицинские процедуры, методы терапии и диагностические исследования, в рамках которых
используется проводимый электрический ток (например, чрескожная электрическая
стимуляция нервов, электрокаутеризация, электролиз или термолиз, электродиагностические
исследования, электромиография или исследования проводимости нервов), могут вызывать
помехи в работе имплантируемого устройства или приводить к его повреждению. Перед
такими процедурами следует запрограммировать аппарат на режим Electrocautery Protection
Mode (Режим электрокаутеризации), а во время процедур — контролировать работу аппарата.
По завершении лечения проверьте работу имплантируемого устройства ("Контроль
имплантируемого устройства после выполнения терапии" на странице 26).
•
Внутренняя дефибрилляция. Не используйте пластины или катетеры для внутренней
дефибрилляции, если только имплантируемое устройство не будет отсоединено от электродов,
потому что электроды могут шунтировать энергию. Это может нанести вред пациенту и повредить
имплантированную систему.
•
Наружная дефибрилляция. На восстановление восприятия после приложения наружного разряда
может потребоваться до 15 секунд. В случаях, не требующих срочного вмешательства, для
зависящих от кардиостимулятора пациентов следует рассмотреть возможность перевода
имплантируемого устройства в режим асинхронной стимуляции и установки сенсора MV (МВ) в
положение Off (Выкл) до выполнения наружной кардиоверсии или дефибрилляции.
21
Использование наружной дефибрилляции или кардиоверсии может повредить имплантируемое
устройство. Во избежание этого учитывайте следующие моменты:
•
Не накладывайте плоские электроды непосредственно над имплантируемым устройством.
Располагайте их как можно дальше от имплантируемого устройства.
•
Накладывайте плоские электроды в задне-передней позиции, если аппарат находится в
правой пекторальной области, или в передне-верхушечной позиции, если аппарат
имплантирован в левой пекторальной области.
•
Установите выходную мощность наружного дефибриллятора на самое низкое клинически
допустимое значение.
После выполнения наружной кардиоверсии или дефибрилляции проверьте функционирование
имплантируемого устройства ("Контроль имплантируемого устройства после выполнения терапии"
на странице 26).
•
Литотрипсия. Дистанционная ударно-волновая литотрипсия (ДУВЛТ) может стать причиной
электромагнитных помех для имплантируемого устройства или его повреждения. Если применение
ДУВЛТ является необходимым, для минимизации вероятности взаимодействия необходимо
учитывать следующее:
•
Сфокусируйте пучок импульсов ДУВЛТ по крайней мере в 15 см (6 дюймах) от
имплантируемого устройства.
•
В зависимости от того, насколько пациенту необходима стимуляция, установите для
параметра Brady Mode (Режим брадикардии) режим стимуляции без частотной адаптации VVI
или VOO.
•
Ультразвуковая энергия. Терапевтическая ультразвуковая энергия (например, литотрипсия) может
повредить имплантируемое устройство. Если необходимо использовать терапевтический
ультразвук, избегайте фокусирования энергии в области ложа аппарата. Нет данных о вредном
22
воздействии диагностического ультразвука (например, эхокардиографии) на имплантируемое
устройство.
•
Электрические помехи. Электрические помехи, или так называемый «шум» от приборов, таких как
электрокаутер или оборудование для мониторинга, могут повлиять на установку и поддержание
телеметрической связи для опроса и программирования аппарата. При таком воздействии
отодвиньте программатор от электроприборов и убедитесь, что шнур телеметрической головки и
кабели не переплетаются между собой. Если в результате помех телеметрическая связь
прерывается, аппарат должен быть повторно опрошен до оценки информации, полученной из
памяти имплантируемого устройства.
•
Радиочастотные (РЧ) помехи. РЧ-сигналы от приборов, работающих на смежной с аппаратом
частоте, могут прервать работу ZIP-телеметрии при опросе или программировании
имплантируемого устройства. Данные РЧ-помехи могут быть уменьшены за счет увеличения
расстояния между аппаратом, создающим помехи, ПРМ и имплантируемым устройством. Примеры
аппаратов, которые могут создавать помехи в частотном диапазоне 869,85 МГц:
•
Радиотелефоны и базовые станции
•
Некоторые виды мониторинговых систем
•
Ввод проводника центрального венозного катетера. Соблюдайте осторожность при введении
направляющих струн для установки других типов центральных венозных систем катетеров, таких
как магистрали PIC или катетеры Hickman в местах, где могут встретиться электроды
имплантируемого устройства. Введение таких проводников в вены с электродами может привести к
повреждению или смещению электродов.
Домашняя и производственная окружающая среда
•
Бытовая техника. Бытовые приборы/техника, находящиеся в исправном рабочем состоянии и
должным образом заземленные, обычно не являются причиной ЭМП и не оказывают воздействия
на работу имплантируемого устройства; сообщалось о нарушениях в работе имплантируемых
23
устройств, вызванных электрическими ручными приборами или электрическими бритвами,
находящимися непосредственно над местом нахождения аппарата.
•
Магнитные поля. Сообщите пациентам о том, что продолжительное нахождение в радиусе
действия сильных (более 10 Гс или 1 мТесла) магнитных полей может активировать магнитную
функцию. Ниже приведены примеры источников магнитных полей.
•
Промышленные преобразователи и электродвигатели
•
Сканеры МРТ
ПРИМЕЧАНИЕ: Магнитная функция отключена, когда аппарат находится в режиме
защиты при МРТ. Дополнительную информацию см. в "Магнитно-резонансная томография
(МРТ)" на странице 27 и Техническом руководстве по МРТ.
•
Большие аудиоколонки
•
Телефонные трубки, если их держать на расстоянии 1,27 см (0,5 дюйма) от имплантируемого
устройства
•
Ручные металлоискатели (например те, которые используются службами безопасности в
аэропортах, а также в игре бинго)
•
Система наблюдения с использованием электронных средств (EAS) и системы
безопасности. Пациентов следует проинструктировать о том, чтобы они не оставались без
необходимости вблизи арочных металлоискателей и проходов, оснащенных устройствами для
выявления воров, или не находились вблизи устройств для считывания этикеток, в которых имеется
оборудование для радиочастотной идентификации (RFID). Такие системы могут находиться на
входе и выходе в крупных универмагах, в публичных библиотеках и в любых местах, оснащенных
системами контроля доступа. Маловероятно, что такие системы смогут повлиять на работу
кардиостимуляционного аппарата, если пациент будет проходить через них с обычной скоростью.
Если, находясь вблизи такого защитного, охранного оборудования или оборудования входного
контроля, пациент почувствует себя плохо, ему следует немедленно отойти от такого оборудования
и связаться с врачом.
24
•
Мобильные телефоны. Посоветуйте пациентам держать сотовые телефоны у уха с
противоположной от аппарата стороны. Пациенты не должны носить включенный сотовый телефон
в нагрудном кармане или на поясе, если расстояние между телефоном и аппаратом менее 15 см (6
дюймов), поскольку в результате воздействия некоторых мобильных телефонов может быть
выполнена неадекватная терапия или, наоборот, необходимая терапия может быть не выполнена.
Тестирование после завершения терапии
•
Тест определения порога стимуляции. Если состояние пациента или лекарственный режим
изменились, или параметры аппарата были перепрограммированы, следует выполнить тесты
определения порогов стимуляции и убедиться в том, что запрограммированные амплитуды имеют
достаточный запас для обеспечения эффективной стимуляции.
•
Вопросы контрольных визитов к врачу для пациентов, выезжающих из страны. Для
пациентов, которые планируют поездку или смену места жительства после имплантации на страну,
отличную от страны, где им была произведена имплантация аппарата, необходимо предпринять
дополнительные меры по обеспечению контроля аппарата после имплантации. Правовые
нормативы и статус аппарата и соответствующих конфигураций программного обеспечения в
различных странах различны. В некоторых странах определенные изделия могут не быть одобрены
или за ними невозможно осуществлять наблюдение.
Свяжитесь с Boston Scientific, используя контактную информацию на задней обложке для получения
консультации по вопросу организации контрольных посещений врача в стране назначения
пациента.
Деимплантация и утилизация
•
Сжигание. Не забудьте извлечь имплантируемое устройство перед кремацией. Температура, при
которой происходит кремирование и сжигание, может стать причиной взрыва имплантируемого
устройства.
25
•
Манипуляции с аппаратом. Перед деимплантацией, очисткой или отправкой аппарата выполните
следующие действия, чтобы избежать перезаписи важных архивных данных по терапии:
•
Установите для параметра Brady Mode (Режим брадикардии) имплантируемого устройства
значение Off (Выкл)
•
Установите для параметра Ventricular Tachy EGM Storage (Хранение ЭГМ желудочковых
тахиаритмий) значение Off (Выкл)
Очистите и продезинфицируйте аппарат с использованием стандартных методов обращения с
биологически опасным материалом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ О ПРЕДОСТОРОЖНОСТИ
Контроль имплантируемого устройства после выполнения терапии
После выполнения хирургического вмешательства или медицинской процедуры, которые могут оказать
влияние на работу имплантируемого устройства, следует выполнить тщательное контрольное
исследование, которое может включать следующие мероприятия:
•
Опрос имплантируемого устройства с помощью программатора
•
Просмотр клинических событий и кодов неисправностей
•
Просмотр журнала Arrhythmia Logbook (Журнал регистрации аритмий), включая сохраненные
электрограммы (ЭГМ)
•
Просмотр ЭГМ в режиме реального времени
•
Тестирование электродов (порог, амплитуда и импеданс)
•
Просмотр диагностических данных и рабочих характеристик сенсора МВ, а также выполнение
ручной калибровки сенсора МВ (при желании)
•
Проверка состояния батареи
26
•
Замена любого постоянного параметра брадикардии на новое значение, а затем обратное
перепрограммирование на нужное значение
•
Сохранение всех данных пациента
•
Проверка надлежащего окончательного программирования перед выпиской пациента из лечебного
учреждения
Магнитно-резонансная томография (МРТ)
Приведенные ниже предостережения и меры предосторожности, а также условия использования
относятся к МРТ пациентов с имплантированной МР-условно безопасной системой стимуляции
ImageReady. Полный список предостережений и мер предосторожности, а также условия использования,
относящиеся к МРТ-сканированию пациентов, которым имплантирована МР-условно безопасная
система стимуляции ImageReady, можно найти в техническом руководстве по МРТ по адресу www.
bostonscientific-international.com/manuals.
Предостережения и меры предосторожности при использовании МР-условно безопасной
системы стимуляции
ПРЕДОСТЕРЕЖЕНИЕ: Если не соблюдены все условия использования МРТ, МРТ-сканирование
пациента не будет соответствовать МР-условно безопасным требованиям для имплантированной
системы, в результате чего возможно причинение пациенту значительного вреда, или смерть пациента,
и/или повреждение имплантированной системы.
Возможные осложнения при соблюдении или несоблюдении условий использования приведены в
техническом руководстве по МРТ. "Магнитно-резонансная томография (МРТ)" на странице 27 содержит
дополнительные предостережения, меры предосторожности и условия использования, касающиеся
МРТ-сканирования.
ПРЕДОСТЕРЕЖЕНИЕ: Оценка совместного использования электродов FINELINE II и INGEVITY MRI с
МР-условно безопасным имплантируемым устройством Boston Scientific не проводилась. Сочетание
этих компонентов не является МР-условно безопасной системой стимуляции ImageReady.
27
ПРЕДОСТЕРЕЖЕНИЕ: Необходимо удостовериться в том, что выбранные/имплантированные
комплектующие системы ImageReady составляют сочетание, приемлемое для МРТ-окружения (для
силы магнита МРТ и рабочего режима [предельные значения SAR]), и что сочетание комплектующих,
силы магнита и рабочего режима (пределы SAR) отвечает всем условиям использования. Сочетание
комплектующих, отличное от указанного, не проходило оценку использования в условиях МРТ-
окружения. Подробную информацию см. в техническом руководстве по МРТ.
ПРЕДОСТЕРЕЖЕНИЕ: Πрограмматор/регистратор/монитор (ПРМ) является МР-небезопасным и не
должен находиться в Зоне III (и выше) того учреждения, где проводится МРТ, согласно определению
методического документа по технике безопасности при МР-процедурах Американского колледжа
радиологии (American College of Radiology Guidance Document for Safe MR Practices)2. Ни при каких
обстоятельствах нельзя приносить ПРМ в палату проведения МРТ, комнату управления и Зону III или IV
МРТ.
ПРЕДОСТЕРЕЖЕНИЕ: Имплантацию системы нельзя проводить в зоне III (и выше) учреждения, где
проводится МРТ, согласно определению методического документа по технике безопасности при МР-
процедурах Американского колледжа радиологии (American College of Radiology Guidance Document for
Safe MR Practices)3 Некоторые принадлежности, поставляемые в комплекте с имплантируемыми
устройствами и электродами, в т. ч. отвертка и стилетные провода, не являются МР-условно
безопасными, и их нельзя приносить в палату проведения МРТ, комнату управления и зоны III или IV
МРТ.
ПРЕДОСТЕРЕЖЕНИЕ: Будьте внимательны при программировании амплитуды стимуляции в MRI
Protection Mode (Режиме защиты при МРТ) для пациентов, зависимых от стимуляции, с высокими
порогами стимуляции (> 2,0 В). Программирование амплитуды стимуляции ниже 5,0 В — вариант на
случай внесердечной стимуляции (например, диафрагмальная стимуляция для стимуляции ПЖ). Если
запрограммированное значение амплитуды стимуляции меньше 5,0 В, необходимо поддерживать
2.
Kanal E, et al., American Journal of Roentgenology 188:1447-74, 2007.
3.
Kanal E, et al., American Journal of Roentgenology 188:1447-74, 2007.
28
надлежащий запас безопасности (2-кратный размер порога стимуляции + 1,0 В). Ненадлежащий запас
безопасности может привести к потере захвата.
ПРЕДУПРЕЖДЕНИЕ: Следует оценить индивидуальную степень переносимости пациентом
параметров стимуляции, необходимых для проведения МРТ, учитывая необходимые физические
условия во время сканирования (например, длительное пребывание в положении лежа).
ПРЕДУПРЕЖДЕНИЕ: Следует учесть, что следующие резервные параметры стимуляции будут
отличаться от нормальной работы в Safety Mode (Безопасный режим), если устройство находилось в
MRI Protection Mode (Режиме защиты при МРТ) (если в качестве значения режима стимуляции не задано
Off (Выключение)) при возвращении в Safety Mode (Безопасный режим):
•
Brady Mode (Режим воздействия на брадикардию) — VOO
•
RV Lead Configuration (Конфигурация электрода ПЖ) — Bipolar (Биполярный)
•
Период RV Refractory (Рефрактерный период ПЖ) (RVRP) — не используется по причине
асинхронной стимуляции
•
RV Sensitivity (Чувствительность ПЖ) — не используется по причине асинхронной стимуляции
•
Noise Response (Реакция на помехи) — не используется по причине асинхронной стимуляции
ПРИМЕЧАНИЕ: Другие имплантированные аппараты или состояния пациента также могут
стать причиной нежелательности МРТ независимо от статуса МР-условно безопасной системы
стимуляции ImageReady пациента.
Условия использования МРТ
Пациент с системой стимуляции ImageReady может проходить МРТ при условии обязательного
выполнения приведенных ниже условий использования. Перед каждой процедурой необходимо
проверять выполнение условий использования. Для оценки возможности и готовности пациента к
прохождению МРТ необходимо использовать самые актуальные данные. Полный список
предостережений и мер предосторожности, а также условия использования, относящиеся к МРТ-
29
сканированию пациентов, которым имплантирована МР-условно безопасная система стимуляции
ImageReady, можно найти в техническом руководстве по МРТ по адресу www.bostonscientific-international.
com/manuals.
Кардиология
1.
Пациенту имплантирована МР-условно безопасная система стимуляции ImageReady
2.
Биполярная стимуляция или стимуляция выключена
3.
Имплантируемое устройство расположено в пределах левой или правой области грудной клетки
4.
После имплантации и (или) проверки электрода или хирургической корректировки МР-условно
безопасной системы стимуляции прошло не менее шести (6) недель
5.
Отсутствие каких-либо кардиологических аппаратов, компонентов или принадлежностей, кроме
МР-условно безопасной системы стимуляции ImageReady, см. техническое руководство по МРТ
6.
Порог стимуляции ≤ 2,0 В у пациентов, зависимых от стимуляции
7.
Отсутствие оставленных электродов или имплантируемых устройств
8.
Отсутствуют признаки нарушения целостности электрода или системы имплантируемого
устройства и электрода
Минимизация конфликта кардиостимулятора с S-ICD
Эти имплантируемые устройства совместимы с подкожно имплантируемыми кардиовертерами-
дефибрилляторами (S-ICD) при условии имплантации с биполярными электродами и программирования
в конфигурацию для биполярной стимуляции.
Кардиостимулятор может взаимодействовать с S-ICD следующим образом:
•
Если во время тахиаритмии работа кардиостимулятора не подавлена, и стимулирующие импульсы
отмечаются воспринимающим частоту контуром S-ICD, в этом случае S-ICD может
30
интерпретировать стимулирующие импульсы как нормальный сердечный ритм. В подобном случае
S-ICD не сможет выявлять аритмию, следовательно, не сможет проводить терапию.
•
Неспособность кардиостимулятора к восприятию или захвату может привести к наличию на S-ICD
двух сигналов: собственного сердечного и стимулирующих импульсов. Это может привести к тому,
что показания частоты, измеренные S-ICD, будут превышать фактическую частоту сердечных
сокращений пациента. В подобной ситуации S-ICD может осуществить ненужную терапию.
•
Если S-ICD учитывает и импульсы стимулятора, и результирующие импульсы желудочковой
деполяризации, то измеренная устройством S-ICD частота будет выше фактической частоты
сердечных сокращений. Это может привести к тому, что S-ICD будет осуществлять ненужную
терапию.
В режиме Safety Mode (Безопасный режим) эти имплантируемые устройства используют монополярную
стимуляцию и воспринимающую конфигурацию. Режим Safety Mode (Безопасный режим) совместим с S-
ICD, поскольку настроенные параметры смягчают взаимодействие кардиостимулятора и S-ICD
следующим образом:
•
Восприятие осуществляется с помощью агоритма AGC (АРУ) при 0,25 мВ. Восприятие в режиме
AGC позволяет эффективно распознавать собственный сердечный ритм быстрее, чем это
делается в режиме Safety Mode LRL (LRL в безопасном режиме) при 72,5 min-1. В результате
стимуляция подавляется и не влияет на распознавание тахиаритмии устройством S-ICD.
•
Если необходима кардиостимуляция, увеличенный выходной сигнал (5,0 В и 1,0 мс) уменьшают
риск пропуска захвата.
•
Если происходит двойное распознавание стимулирующего импульса и возникающей в результате
деполяризации, это не приведет в результате к ненужной терапии со стороны устройства S-ICD,
при условии, что порог тахикардии для S-ICD составит более чем двойное значение порога Safety
Mode LRL (LRL в безопасном режиме) (145 min-1).
31
Чтобы уменьшить взаимодействие двух аппаратов при имплантации биполярного кардиостимулятора
пациенту, у которого уже имеется имплантированный S-ICD, следует соблюдать такие меры
предосторожности:
•
Биполярные стимулирующие электроды следует располагать в обеих камерах так, чтобы
расстояние между полюсами было небольшим. Значительное расстояние между полюсами может
повысить вероятность того, что S-ICD обнаружит стимулирующие импульсы.
•
Можно запрограммировать кардиостимулятор: (1) на самую низкую Amplitude (Амплитуду) из
допустимых при хроническом состоянии для безопасного захвата; (2) на максимальную Sensitivity
(Чувствительность) при сохранении адекватных пределов безопасности; (3) на минимальную
частоту сердечных сокращений, приемлемую для данного пациента.
Вдобавок к вышеуказанным шагам нужно провести следующие испытания для оценки межаппаратного
взаимодействия.
•
Использовать свойства S-ICD, такие как маркеры, электрограммы в реальном времени (ЭГ) и/или
звуковые тональные сигналы для оценки возможного взаимодействия с кардиостимулятором из-за
излишнего восприятия сигналов аппаратом S-ICD.
ПРИМЕЧАНИЕ: Если пациенту имплантирован однокамерный кардиостимулятор с предсердным
электродом, испытания надо выполнить и в монополярной, и в биполярной конфигурации.
•
Фибрилляции желудочков и все желудочковые тахиаритмии пациента следует вызывать при
активированном имплантируемом устройстве S-ICD и при работе кардиостимулятора в
асинхронном режиме с максимальной Amplitude (Амплитудой) и Pulse Width (Шириной импульса).
Таким образом, создадутся условия для подавления детекции аритмий из-за регистрации
стимулирующих импульсов кардиостимулятора. Возможно, стимулирующие электроды
потребуется переместить для устранения детектирования импульсов кардиостимуляции
аппаратом S-ICD.
32
Следует временно отключить устройство S-ICD пациента в случае, когда (1) оцениваются пороги
восприятия и кардиостимуляции, (2) при использовании внешнего временного кардиостимулятора во
время имплантации и (3) при перепрограммировании имплантированного кардиостимулятора.
После любого разряда аппарата S-ICD следует заново опросить кардиостимулятор и убедиться в том,
что разряд S-ICD не повредил кардиостимулятор.
Следует сверяться с руководством по эксплуатации аппарата S-ICD при имплантации S-ICD пациенту, у
которого уже установлен кардиостимулятор.
Дополнительную информацию о взаимодействии кардиостимулятора и аппарата S-ICD см. в разделе
"Предупреждения".
Чреcкожная электронейростимуляция (ЧЭНС)
ПРЕДУПРЕЖДЕНИЕ: ЧЭНС подразумевает прохождение электрического тока через тело, и это может
повлиять на функционирование имплантируемого устройства. Если применение ЧЭНС необходимо с
медицинской точки зрения, проверьте настройки выполнения терапии ЧЭНС на совместимость с данным
имплантируемым устройством. Следующие рекомендации могут помочь снизить вероятность
взаимодействия:
•
По возможности установите электроды для ЧЭНС как можно ближе друг к другу и как можно
дальше от имплантируемого устройства и электродов.
•
Используйте самую малую из клинически одобренных мощностей ЧЭНС.
•
Pассмотрите возможность применения кардиомониторинга при применении ЧЭНС, особенно у
пациентов, зависящих от кардиостимуляторов.
Можно предпринять дополнительные шаги для попытки снижения воздействия при клиническом
использовании ЧЭНС:
•
Если во время клинического применения есть подозрение на взаимодействие, то следует
выключить аппарат ЧЭНС.
33
•
Если наблюдается блокировка стимуляции, используйте магнит для асинхронной стимуляции.
•
Не изменяйте настройки ЧЭНС до тех пор, пока не убедитесь, что новые настройки не оказывают
воздействия на работу имплантируемого устройства.
Если необходимо проведение ЧЭНС не в клинических условиях (использование дома), дайте пациентам
следующие рекомендации:
•
Не изменять настройки ЧЭНС или положения полюсов, если не было особых указаний сделать это.
•
Заканчивать каждый сеанс ЧЭНС отключением аппарата до удаления полюсов.
•
Если во время использования ЧЭНС у пациента отмечаются признаки дурноты, головокружения
или потери сознания, следует отключить аппарат ЧЭНС и связаться с врачом.
Для оценки работы имплантируемого устройства во время применения ЧЭНС выполните следующие
действия с использованием программатора:
1.
Следите за ЭГМ в режиме реального времени на предписанных выходных значениях ЧЭНС,
отмечая, когда происходит надлежащее восприятие или воздействие.
ПРИМЕЧАНИЕ: Инициируемый пользователем мониторинг также может использоваться в
качестве дополнительного метода подтверждения функционирования аппарата при применении
ЧЭНС.
2.
По окончании отключите аппарат ЧЭНС.
Также необходимо проводить надлежащую контрольную оценку имплантируемого устройства после
ЧЭНС, чтобы убедиться в должном функционировании аппарата ("Контроль имплантируемого
устройства после выполнения терапии" на странице 26).
Для получения дополнительной информации обращайтесь в Boston Scientific, используя данные на
последней странице обложки.
34
Электрокаутеризация и радиочастотная (РЧ) абляция
ПРЕДУПРЕЖДЕНИЕ: РЧ-аблация и электрокаутеризация могут индуцировать желудочковые
тахиаритмии и/или фибрилляцию желудочков, а также может быть причиной асинхронной стимуляции,
ингибирования стимуляции и/или снижения выходной мощности стимуляции, выполняемой
имплантируемым устройством, что может привести к потере захвата. РЧ-аблация может также вызвать
желудочковую стимуляцию до уровня максимальной частоты отслеживания и/или изменений в порогах
стимуляции. Кроме того, будьте особенно осторожны при выполнении любого другого вида аблации
сердца у пациентов с имплантированными аппаратами.
Если электрокаутеризация или РЧ-абляция являются необходимыми с медицинской точки зрения, для
сведения к минимуму рисков для пациентов и аппарата соблюдайте следующие рекомендации:
•
В зависимости от потребностей стимуляции пациента включите Electrocautery Protection Mode
(Режим защиты при электрокаутеризации), установите режим асинхронной стимуляции или
воспользуйтесь магнитом, чтобы переключиться на асинхронную стимуляцию. Для пациентов с
естественным ритмом можно установить Brady Mode (Режим брадикардии) в положение VVI
(Однокамерная желудочковая стимуляция по требованию) на частоте ниже собственного
показателя, чтобы избежать конкурирующей стимуляции.
•
Необходимо располагать оборудованием для временной стимуляции и наружной дефибрилляции.
•
Избегайте прямого контакта электрокаутеров или абляционных катетеров с имплантируемым
устройством и электродами. РЧ-абляция, выполняемая рядом с местом нахождения полюса
электрода, может повредить место контакта электрода с тканью.
•
Старайтесь, чтобы линия прохождения электрического тока находилась как можно дальше от
имплантируемого устройства и электродов.
•
Если РЧ-абляция и (или) электрокаутеризация выполняются на ткани рядом с аппаратом или
электродами, отслеживайте пороги восприятия и стимуляции, а также значения импеданса до и
после проведения процедуры, чтобы определить целостность и стабильность системы.
35
•
В отношении электрокаутеризации — по возможности используйте только биполярную систему
электрокаутеризации и короткие, прерывистые и нерегулярные импульсы самого низкого из
возможных уровня энергии.
•
Оборудование для РЧ-абляции может вызывать помехи в телеметрической связи между
имплантируемым устройством и программатором. Если при РЧ-абляции необходимы изменения в
программировании аппарата, отключите оборудование для РЧ-абляции до выполнения запроса.
Когда процедура окончена, отмените Electrocautery Protection Mode (Режим защиты при
электрокаутеризации), чтобы реактивировать ранее запрограммированные режимы терапии.
Ионизирующее излучение
ПРЕДУПРЕЖДЕНИЕ: Невозможно определить безопасную дозу излучения или гарантировать
надлежащее функционирование имплантируемого устройства после воздействия ионизирующего
излучения. Множественные факторы в совокупности определяют воздействие лучевой терапии на
имплантируемое устройство, включая близость имплантируемого устройства к пучку излучения, тип и
уровень энергии пучка излучения, интенсивность дозы излучения, общую дозу излучения за весь срок
службы аппарата и экранирование имплантируемого устройства. Воздействие ионизирующего
излучения также будет отличаться для разных имплантируемых устройств и может варьироваться от
отсутствия изменений в работе аппарата до невозможности выполнения стимуляции.
Источники ионизирующего излучения очень сильно различаются своим потенциальным воздействием на
имплантируемое устройство. Некоторые источники терапевтического излучения способны
воздействовать на имплантируемое устройство и повредить его, включая источники излучения,
используемые для лечения рака, например радиоактивный кобальт, линейные ускорители,
радиоактивные импланты и бетатроны.
36
Прежде чем начать курс лучевой терапии, онколог-радиолог и кардиолог или электрофизиолог пациента
должны учесть все варианты контроля над пациентом, включая увеличенное количество контрольных
проверок и замену аппарата. Другие соображения включают:
•
Максимальное экранирование имплантируемого устройства в поле облучения
•
Определение необходимого уровня мониторинга пациента при облучении
Оцените работу имплантируемого устройства во время и после курса лучевой терапии, чтобы
задействовать как можно больше возможностей аппарата ("Контроль имплантируемого устройства
после выполнения терапии" на странице 26). Степень, временные рамки и частота подобных оценок
работы в отношении режима лучевой терапии зависят от текущего состояния здоровья пациента, и,
следовательно, должны быть определены лечащим кардиологом или электрофизиологом.
Многие диагностические процедуры выполняются имплантируемым устройством в автоматическом
режиме раз в час, поэтому оценка имплантируемого устройства не должна завершиться до обновления и
просмотра диагностических данных имплантируемого устройства (по крайней мере, через один час
после воздействия облучения). Последствия воздействия излучения на имплантируемое устройство
могут оставаться нераспознанными до пришествия определенного времени после воздействия. По этой
причине продолжайте тщательно отслеживать функцию имплантируемого устройства и соблюдать
осторожность при программировании функций через несколько недель или месяцев после воздействия
лучевой терапии.
Повышенное давление
Международная организация по стандартизации (ИСО) не одобрила стандартизированный тест по
давлению для имплантируемых устройств, подвергавшихся воздействию гипербарической оксигенации
(ГБО) или подводному плаванию с аквалангом. Однако Boston Scientific разработала протокол
тестирования для оценки работы аппарата при воздействии повышенного атмосферного давления.
Следующая обобщающая информация по тестированию под давлением не должна рассматриваться в
качестве поддерживающей и не является таковой в отношении ГБО или подводного плавания с
аквалангом.
37

ПРЕДУПРЕЖДЕНИЕ: Повышенное давление вследствие воздействия ГБО или подводного плавания с
аквалангом может повредить устройство. При лабораторных испытаниях все имплантируемые
устройства в экспериментальной выборке функционировали в соответствии со своими конструктивными
особенностями при воздействии более 1 000 циклов при давлении 5,0 атм. Лабораторные испытания не
подтвердили воздействие повышенного давления на работу имплантируемых устройств или
физиологическую реакцию при имплантировании в теле человека.
Для каждого цикла испытаний давление начиналось с окружающего/комнатного давления,
увеличивалось до давления высокого уровня, а затем возвращалось к исходному окружающему
давлению. И хотя время выдержки (количество времени воздействия повышенного давления) может
оказывать воздействие на физиологию человека, испытания показали, что оно не оказало какого-либо
влияния на работу имплантируемого устройства. Эквивалентные значения давления представлены ниже
(Таблица 1 Эквивалентные значения давления на странице 38).
Таблица 1. Эквивалентные значения давления
Эквивалентные значения давления
Абсолютных атмосфер
5,0 атм
Глубина морской водыa
40 м (130 футов)
Давление, абсолютное
72,8 фунт/кв.дюйм (абс.)
Давление, манометрическоеb
58,1 фунт/кв.дюйм (манометр.)
38

Таблица 1. Эквивалентные значения давления (продолжение)
Эквивалентные значения давления
Бар
5,0
кПа (абс.)
500
a. Все показания давления были получены из расчета плотности морской воды, равной 1030 кг/м3.
b. Показания давления на манометре или датчик давления с циферблатной шкалой (фунт/кв.дюйм (абс.) = фунт/кв.
дюйм (манометр.) + 14,7 фунт/кв.дюйм).
Перед погружением под воду с аквалангом или началом программы гипербарической оксигенации
необходимо проконсультироваться с лечащим кардиологом или электрофизиологом, чтобы полностью
понять возможные последствия в свете конкретного состояния здоровья пациента. Перед погружением с
аквалангом, возможно, будет также необходимо проконсультироваться с медиком-специалистом по
подводному плаванию.
Возможно, потребуются более частые контрольные сеансы для проверки аппарата, связанные с
гипербарической оксигенацией или подводным плаванием. Оцените работу имплантируемого
устройства после воздействия высокого давления ("Контроль имплантируемого устройства после
выполнения терапии" на странице 26). Степень, временные параметры и частота таких проверок по
причине воздействия высокого давления зависят от текущего состояния пациента и должны быть
определены кардиологом или электрофизиологом.
Если возникли дополнительные вопросы или требуется более подробная информация в отношении
протокола тестирования или результатов тестирования конкретно в отношении гипербарической
оксигенации или подводного плавания с аквалангом, обратитесь в Boston Scientific, используя
информацию на задней стороне обложки.
39
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ
На основе литературных источников и (или) опыта использования имплантируемых устройств и (или)
электродов в следующем списке приведены возможные нежелательные события, связанные с
имплантацией изделий, описанных в этих литературных источниках:
•
Воздушная эмболия
•
Аллергическая реакция
•
Кровотечение
•
Брадикардия
•
Тампонада сердца
•
Хроническое повреждение нервов
•
Выход из строя составляющих компонентов
•
Перелом спирали проводника
•
Летальный исход
•
Повышение порогов стимуляции
•
Эрозия
•
Чрезмерное образование фиброзной ткани
•
Экстракардиальная стимуляция (мышечная стимуляция/стимуляция нервов)
•
Скопление жидкости
•
Явления отторжения инородного тела
•
Образование гематом и сером
•
Блокада сердца
•
Сердечная недостаточность вследствие апикальной стимуляции RV (ПЖ)
•
Невозможность проведения стимуляции
40
•
Ненадлежащая стимуляция
•
Боли в области послеоперационного шва
•
Неполное соединение электрода с имплантируемым устройством
•
Инфекция, включая эндокардит
•
Смещение электрода
•
Перелом электрода
•
Нарушение изоляции или истирание электрода
•
Перфорация электрода
•
Деформация и/или отламывание кончика электрода
•
Местная реакция ткани
•
Потеря захвата
•
Инфаркт миокарда (ИМ)
•
Некроз миокарда
•
Травма миокарда (например, повреждение ткани, клапана)
•
Восприятие миопотенциалов
•
Избыточное/недостаточное восприятие
•
Кардиостимуляционная тахикардия (PMT) (относится только к двухкамерным аппаратам)
•
Трения перикарда, выпот
•
Пневмоторакс
•
Миграция имплантируемого устройства
•
Шунтирование тока при дефибрилляции с помощью внутренних или наружных электродов-пластин
•
Обморок
41
•
Тахиаритмии, в том числе акселерация аритмий и ранняя рецидивирующая фибрилляция
предсердий
•
Тромбоз/тромбоэмболия
•
Повреждение клапана
•
Вазовагальный отклик
•
Окклюзия вены
•
Травма вены (например, перфорация, расслоение, эрозия)
•
Усугубление сердечной недостаточности
Список возможных осложнений, связанных с МРТ, приведен в техническом руководстве по МРТ.
У пациентов может развиться психологическое неприятие системы имплантируемого устройства, и они
могут испытывать следующие состояния:
•
Зависимость
•
Депрессия
•
Страх преждевременного разряда батареи
•
Боязнь нарушения работы аппарата
МЕХАНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Следующие механические характеристики и характеристики материалов относятся к аппаратам
ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2.
42

Таблица 2. Механические характеристики - все кардиостимуляторы
SR
DR
DR EL
VDDR
Площадь
29,10
28,92
35,05
28,92
поверхности
полюса корпуса
(см2)
Используемая
1,0
1,0
1,6
1,0
емкость батареи
(А·ч)
Остаточная
0,07
0,09
0,09
0,07
используемая
емкость батареи
при
деимплантации
(А·ч)
Механические характеристики для каждой конкретной модели приведены ниже.
43
Таблица 3. Механические характеристики - кардиостимуляторы ACCOLADE
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L300
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV
(ПЖ): IS-1
L301
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
L310
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV
(ПЖ): IS-1
L311
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
44

Таблица 4. Механические характеристики - кардиостимуляторы ACCOLADE EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L321
4,45 x 5,88 x 0,75
29,1
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
L331
4,45 x 5,88 x 0,75
29,2
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 5. Механические характеристики - кардиостимуляторы PROPONENT
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L200
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV
(ПЖ): IS-1
L201
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
L209 (модель
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
VDDR)
(ПЖ): IS-1
45

Таблица 5. Механические характеристики - кардиостимуляторы PROPONENT (продолжение)
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
Модель МРТ
L210
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV
(ПЖ): IS-1
L211
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 6. Механические характеристики - кардиостимуляторы PROPONENT EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L221
4,45 x 5,88 x 0,75
29,1
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
L231
4,45 x 5,88 x 0,75
29,2
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
46
Таблица 7. Механические характеристики - кардиостимуляторы ESSENTIO
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L100
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV (ПЖ):
IS-1
L101
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
L110
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV (ПЖ):
IS-1
L111
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
47

Таблица 8. Механические характеристики - кардиостимуляторы ESSENTIO EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
L121
4,45 x 5,88 x 0,75
29,1
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
L131
4,45 x 5,88 x 0,75
29,2
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 9. Механические характеристики - кардиостимуляторы ALTRUA 2
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
S701
4,45 x 4,81 x 0,75
23,6
13,2
RA (ПП)/RV (ПЖ):
IS-1
S702
4,45 x 5,02 x 0,75
24,8
13,7
RA (ПП): IS-1; RV
(ПЖ): IS-1
48

Таблица 10. Механические характеристики - кардиостимуляторы ALTRUA 2 EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
S722
4,45 x 5,88 x 0,75
29,1
15,8
RA (ПП): IS-1; RV
(ПЖ): IS-1
В аппаратах ACCOLADE, PROPONENT и ESSENTIO доступна телеметрия ZIP с частотой передачи от
402 до 405 МГц.
Технические характеристики материалов приведены ниже:
•
Корпус: герметизированный титан
•
Головка: имплантационный полимер
•
Источник питания (ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2) для моделей SR, DR и
VDDR: литий-монофторуглеродный элемент; Boston Scientific; 402290
•
Источник питания (ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2) для моделей DR EL: литий-
монофторуглеродный элемент; Boston Scientific; 402294
Ниже приведены следующие механические характеристики и характеристики материалов
аппаратов FORMIO, VITALIO, INGENIO и ADVANTIO.
49
Таблица 11. Механические характеристики - все кардиостимуляторы
SR
DR
DR EL
VDDR
Площадь
29,78
29,78
35,98
29,78
поверхности
полюса корпуса
(см2)
Используемая
1,05
1,05
1,47
1,05
емкость батареи
(А·ч)
Остаточная
0,06
0,08
0,08
0,07
используемая
емкость батареи
при
деимплантации
(А·ч)
Механические характеристики для каждой конкретной модели приведены ниже.
50
Таблица 12. Механические характеристики - кардиостимуляторы FORMIO
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J278
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
J279
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 13. Механические характеристики - кардиостимуляторы VITALIO
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J272
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV
(ПЖ): IS-1
J273
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
51

Таблица 13. Механические характеристики - кардиостимуляторы VITALIO (продолжение)
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J275
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV
(ПЖ): IS-1
J276
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 14. Механические характеристики - кардиостимуляторы VITALIO EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J274
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
J277
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
52

Таблица 15. Механические характеристики - кардиостимуляторы INGENIO
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J172
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV (ПЖ):
IS-1
J173
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
J178 (модель
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
VDDR)
(ПЖ): IS-1
Модель МРТ
J175
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV (ПЖ):
IS-1
J176
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
53
Таблица 16. Механические характеристики - кардиостимуляторы INGENIO EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J174
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
J177
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 17. Механические характеристики - кардиостимуляторы ADVANTIO
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J062
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV (ПЖ):
IS-1
J063
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
54
Таблица 17. Механические характеристики - кардиостимуляторы ADVANTIO (продолжение)
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J065
4,45 x 4,57 x 0,75
23,5
11,5
RA (ПП)/RV (ПЖ):
IS-1
J066
4,45 x 4,70 x 0,75
24,5
12,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Таблица 18. Механические характеристики - кардиостимуляторы ADVANTIO EL
Модель
Размеры
Масса (г)
Объем (см3)
Тип коннектора
Ш x В x Г (см)
J064
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
Модель МРТ
J067
4,45 x 5,56 x 0,75
32,0
14,0
RA (ПП): IS-1; RV
(ПЖ): IS-1
55
В аппаратах FORMIO, VITALIO, INGENIO и ADVANTIO доступна телеметрия ZIP с частотой передачи
869,85 МГц. Имплантируемое устройство, кроме того, определяется как оснащенное приемником 2
класса и работающее с коэффициентом загрузки 4 класса4.
Технические характеристики материалов приведены ниже:
•
Корпус: герметизированный титан
•
Головка: имплантационный полимер
•
Источник питания (FORMIO, VITALIO, INGENIO и ADVANTIO) для моделей SR, DR и VDDR: Литий-
фторуглеродный и серебряно-оксидванадиевый элемент; Greatbatch 2808
•
Источник питания (FORMIO, VITALIO, INGENIO и ADVANTIO) для моделей DR EL: литий-
диоксидмарганцевый элемент; Boston Scientific; 402125
КОМПОНЕНТЫ, ВХОДЯЩИЕ В КОМПЛЕКТ
Имплантируемое устройство имеет следующую комплектацию:
•
Одна отвертка
•
Товаросопроводительная документация
ПРИМЕЧАНИЕ: Принадлежности (например, гаечные ключи) предназначены только для
однократного использования. Их нельзя стерилизовать и повторно использовать.
ПРЕДОСТЕРЕЖЕНИЕ: Имплантацию системы нельзя проводить в зоне III (и выше) учреждения, где
проводится МРТ, согласно определению методического документа по технике безопасности при МР-
процедурах Американского колледжа радиологии (American College of Radiology Guidance Document for
Safe MR Practices)5 Некоторые принадлежности, поставляемые в комплекте с имплантируемыми
устройствами и электродами, в т. ч. отвертка и стилетные провода, не являются МР-условно
4.
в соответствии со стандартом EN 300 220-1.
5.
Kanal E, et al., American Journal of Roentgenology 188:1447-74, 2007.
56

безопасными, и их нельзя приносить в палату проведения МРТ, комнату управления и зоны III или IV
МРТ.
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ НА УПАКОВКЕ
На упаковке и маркировке (Таблица 19 Условные обозначения на упаковке на странице 57) могут
использоваться следующие условные обозначения:
Таблица 19. Условные обозначения на упаковке
Условное обозначение
Описание
Каталожный номер
Содержимое упаковки
Имплантируемое устройство
Отвертка
Прилагаемая литература
57

Таблица 19. Условные обозначения на упаковке (продолжение)
Условное обозначение
Описание
Серийный номер
Использовать до
Номер партии
Дата производства
Стерилизовано оксидом этилена
Не стерилизуйте повторно
Не используйте повторно
58
Таблица 19. Условные обозначения на упаковке (продолжение)
Условное обозначение
Описание
Не используйте, если упаковка повреждена
Обратитесь к Инструкции по эксплуатации на этом веб-
Температурные ограничения
Символ СЕ соответствия требованиям уполномоченного
органа, разрешающего использование знака
Разместите телеметрическую головку здесь
Открыть здесь
,
59

Таблица 19. Условные обозначения на упаковке (продолжение)
Условное обозначение
Описание
Уполномоченный представитель в Европейском
сообществе
Изготовитель
Символ C-Tick с кодами поставщика
Маркировка соответствия требованиям Управления по
связи и средствам массовой информации Австралии
(ACMA)
Маркировка соответствия требованиям регулятора по
управлению использованием радио-частотного спектра
(RSM) Новой Зеландии
Адрес спонсора в Австралии
МР-условно безопасный
60

Таблица 19. Условные обозначения на упаковке (продолжение)
Условное обозначение
Описание
Кардиостимулятор RV (ПЖ)
Кардиостимулятор RA (ПП), RV (ПЖ)
CRT-P RA (ПП), RV (ПЖ), LV (ЛЖ)
Аппарат без покрытия
РЧ-телеметрия
ЗАВОДСКИЕ СПЕЦИФИКАЦИИ
Заводские параметры имплантируемого устройства см. в таблице (Таблица 20 Заводские спецификации
на странице 62).
61

Таблица 20. Заводские спецификации
Параметр
Настройка
Pacing Mode (Режим стимуляции)
Storage (Хранение)
Возможность проведения
DDDR (модели DR) SSIR (модели SR) VDDR (модели
стимулирующей терапии
VDDR)
Sensor (Сенсор)
Blend (Accel and MV) (Смешивание показателей сенсоров
(Аксел-р и МВ))
Конфигурация Pace/Sense (Стимуляции/
RA (ПП): BI/BI (модели ACCOLADE, PROPONENT,
восприятия)
ESSENTIO и ALTRUA 2 DR)
Конфигурация Pace/Sense (Стимуляции/
RA (ПП): -/BI (модели PROPONENT VDDR)
восприятия)
Конфигурация Pace/Sense (Стимуляции/
RV (ПЖ): BI/BI (модели ACCOLADE, PROPONENT,
восприятия)
ESSENTIO и ALTRUA 2)
Конфигурация Pace/Sense (Стимуляции/
RA (ПП): UNI/UNI (FORMIO, VITALIO, INGENIO и
восприятия)
ADVANTIO) для моделей DR:
Конфигурация Pace/Sense (Стимуляции/
RA (ПП): -/UNI (модели INGENIO VDDR)
восприятия)
62

Таблица 20. Заводские спецификации (продолжение)
Параметр
Настройка
Конфигурация Pace/Sense (Стимуляции/
RV (ПЖ): UNI/UNI (для моделей FORMIO, VITALIO,
восприятия)
INGENIO и ADVANTIO)
Magnet Rate (Магнитная частота)
100 min-1
С целью увеличения срока службы имплантируемое устройство поставляется с активированным
энергосберегающим режимом Storage (Хранение). В режиме Storage (Хранение) все функции, за
исключением указанных ниже, отключены:
•
Поддержка телеметрии, позволяющая выполнять запрос данных и программирование
•
Часы реального времени
•
Команда STAT PACE (СТАТИЧЕСКАЯ СТИМУЛЯЦИЯ)
Аппарат выходит из режима Storage (Хранение) при выполнении одного из указанных далее действий;
тем не менее, программирование других параметров не повлияет на режим Storage (Хранение):
•
Активирована команда STAT PACE (СТАТИЧЕСКАЯ СТИМУЛЯЦИЯ)
•
Имплантируемое устройство автоматически обнаруживает вводимый электрод (см. "Имплантация
имплантируемого устройства" на странице 79)
•
Device Mode (Режим аппарата) запрограммирован на Exit Storage (Выход из режима хранения)
После того, как имплантируемое устройство запрограммировано на выход из режима Storage
(Хранение), аппарат не может быть запрограммирован опять на этот режим.
63
ИДЕНТИФИКАТОР, ВИДИМЫЙ С ПОМОЩЬЮ РЕНТГЕНОВСКОГО ИЗЛУЧЕНИЯ
Имплантируемое устройство имеет идентификатор, который можно увидеть на рентгеновском снимке
или при флюороскопии. Данный идентификатор обеспечивает бесконтактное подтверждение
изготовителя и состоит из следующих элементов:
•
Буквы BSC указывают на изготовителя — компанию Boston Scientific
ПРИМЕЧАНИЕ: Эти символы предваряются темным треугольником для обозначения МР-
условно безопасного статуса.
•
Число 012 для имплантируемых устройств (ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2).
Это число обозначает программное обеспечение системы ПРМ модели 2869, необходимое для
коммуникации с имплантируемым устройством.
•
Это число 011 для имплантируемых устройств FORMIO, VITALIO, INGENIO и ADVANTIO. Это число
обозначает программное обеспечение системы ПРМ модели 2869, необходимое для коммуникации
с имплантируемым устройством.
Идентификатор рентгеновского излучения встроен в головку аппарата. В левосторонних грудных
имплантатах идентификатор может быть видимым на рентгенограмме или флюорограмме, примерно в
показанном месте (Рисунок 1 Идентификатор рентгеновского излучения на странице 65).
64
[1] Идентификатор рентгеновского излучения [2] Головка [3] Корпус имплантируемого устройства
Рисунок 1. Идентификатор рентгеновского излучения
Информацию об идентификации аппарата через систему ПРМ см. в руководстве пользователя системы
ПРМ.
Номер модели имплантируемого устройства хранится в памяти аппарата и показан на экране Summary
(Резюме) системы ПРМ после отправки запроса на имплантируемое устройство.
СРОК СЛУЖБЫ ИМПЛАНТИРУЕМОГО УСТРОЙСТВА
Ниже приведен средний прогнозируемый срок службы данных имплантируемых устройств до момента
деимплантации на основе имитационных исследований.
Данные прогнозные значения, зависящие от энергии, потребляемой при производстве и хранении
продукции, применимы при приведенных в таблице условиях, наряду со следующим:
•
Предполагаемые настройки: 60 min-1LRL, Pulse Width (Длительность импульса) стимуляции для
желудочков и предсердий составляет 0,4 мс, для сенсоров задан параметр On (Вкл.).
65
•
Данные расчеты сделаны также при условии, что параметр Onset для электрограммы включен и
что имплантируемое устройство в течение 6 месяцев находится в режиме Storage (Хранение) во
время доставки и хранения.
Следующие таблицы срока службы и условий использования применимы для аппаратов
ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2.
Таблица 21. Ожидаемый срок службы имплантируемого устройства (от имплантации до
деимплантации)
Все моделиa
Срок службы (лет) при импедансе стимуляции 500 Ом, 750 Ом
и 1000 Ом
500 Ω
750 Ω
1000 Ω
Стиму-
SR DR DR VD-
SR DR DR VD-
SR DR DR VD-
ляция
EL
DR
EL
DR
EL
DR
Амплитуды A и V 3,5 В
50 %
9,2
7,6
12,2
9,0
9,7
8,3
13,2
9,4
10,0
8,7
13,9
9,7
100 %
7,9
5,9
9,5
7,7
8,6
6,8
10,9
8,4
9,1
7,4
11,8
8,8
Амплитуды A и V 2,5 В
66
Таблица 21. Ожидаемый срок службы имплантируемого устройства (от имплантации до
деимплантации) (продолжение)
Все моделиa
Срок службы (лет) при импедансе стимуляции 500 Ом, 750 Ом
и 1000 Ом
500 Ω
750 Ω
1000 Ω
Стиму-
SR DR DR VD-
SR DR DR VD-
SR DR DR VD-
ляция
EL
DR
EL
DR
EL
DR
50 %
10,0
8,8
14,0
9,8
10,4
9,3
14,8
10,0
10,5
9,5
15,2
10,2
100 %
9,2
7,6
12,1
9,0
9,7
8,2
13,2
9,4
10,0
8,7
13,9
9,7
a. Предполагаемое время использования ZIP-телеметрии составляет 1 час при имплантации и 40 минут ежегодно при
последующих проверках в клинических условиях.
Сроки службы при настройках «в наихудшем случае» 5,0 В; 500 Ом; 1,0 мс:
•
При 70 min-1: 3,3 года для моделей SR и 1,8 года для моделей DR; 3,1 года для моделей DR EL; 3,3
года для моделей VDDR
•
При 100 min-1: 2,5 года для моделей SR и 1,2 года для моделей DR; 2,1 года для моделей DR EL; 2,5
года для моделей VDDR
Сроки службы при LRL (Нижний предел частоты) 70 min-1 500 Ом; 0,5 мс; 100 % стимуляции, сенсоры On
(Вкл), и максимальном режиме стимуляции: Модели SR при 2,5 В = 8,6 года, при 5,0 В = 5,0 года; модели
DR при 2,5 В = 6,8 года, при 5,0 В = 3,0 года; модели DR EL при 2,5 В = 10,9 года, при 5,0 В = 5,1 года;
модели VDDR при 2,5 В = 8,4 года, при 5,0 В = 4,9 года.
67
ПРИМЕЧАНИЕ: Энергопотребление, приведенное в таблице со сроками эксплуатации, основано на
теоретических принципах и протестировано исключительно в лабораторных условиях.
Срок службы имплантируемого устройства можно увеличить за счет сокращения следующего:
•
Частота стимуляции
•
Амплитуда стимулирующего импульса (импульсов)
•
Ширина стимулирующего импульса (импульсов)
•
Процентное соотношение событий стимуляции к событиям восприятия
Срок службы аппарата также изменяется при следующих обстоятельствах:
•
При снижении импеданса стимуляции срок службы может уменьшаться.
•
Если МВ-сенсор запрограммирован на Off (Выкл) на весь срок работы аппарата, его срок службы
увеличивается приблизительно на 5 месяцев.
•
Если функция Patient Triggered Monitor (Запускаемый пациентом монитор) запрограммирована на
On (Вкл) в течение 60 дней, то срок службы устройства снижается приблизительно на пять дней.
•
Один дополнительный час телеметрической связи ZIP снижает срок службы аппарата
приблизительно на 8 дней.
•
Следующие варианты использования устройства LATITUDE уменьшат срок службы примерно на
10 месяцев: Ежедневные проверки аппарата включены, ежемесячные полные проверки
(дистанционные контрольные сеансы и ежеквартальный запрос данных пациентом). Ежедневные
проверки устройства и ежеквартальные полные опросы уменьшают срок службы примерно на 9
месяцев.
•
Пять запускаемых пациентом запросов коммуникатору LATITUDE в неделю в течение года снижают
срок службы приблизительно на 40 дней.
•
24 часа в режиме MRI Protection Mode (Режим защиты при МРТ) со стимуляцией On (Вкл) снижает
срок службы приблизительно на пять дней.
68

•
Если РЧ-телеметрия отключена на весь срок работы аппарата, его срок службы увеличивается
приблизительно на 6 месяцев (Altrua 2).
•
Дополнительные 6 месяцев в режиме Storage (Хранение) до имплантации снижают срок службы
приблизительно на 80 дней. Предполагаемые настройки имплантируемого устройства: 60 min-1LRL,
Amplitude (Амплитуда) стимулирующего импульса — 2,5 В, Pulse Width (Длительность импульса)
стимуляции — 0,4 мс, Impedance (Импеданс) стимуляции — 500 Ом, 100-процентная стимуляция.
На срок службы аппарата могут также влиять следующие факторы:
•
Допустимые отклонения для электрических компонентов
•
Отклонения в программируемых параметрах
•
Отклонения в эксплуатации вследствие состояния пациента
Следующие таблицы срока службы и условий использования применимы для аппаратов
FORMIO, VITALIO, INGENIO и ADVANTIO.
Таблица 22. Ожидаемый срок службы имплантируемого устройства (от имплантации до
деимплантации)
Все моделиab
Срок службы (лет) при импедансе стимуляции 500 Ом, 750 Ом
и 1000 Ом
500 Ω
750 Ω
1000 Ω
Стиму-
SR DR DR VD-
SR DR DR VD-
SR DR DR VD-
ляция
EL
DR
EL
DR
EL
DR
Амплитуды A и V 3,5 В
69
Таблица 22. Ожидаемый срок службы имплантируемого устройства (от имплантации до
деимплантации) (продолжение)
Все моделиab
Срок службы (лет) при импедансе стимуляции 500 Ом, 750 Ом
и 1000 Ом
500 Ω
750 Ω
1000 Ω
Стиму-
SR DR DR VD-
SR DR DR VD-
SR DR DR VD-
ляция
EL
DR
EL
DR
EL
DR
50 %
8,5
7,0
9,9
8,1
9,0
7,5
10,7
8,7
9,2
7,8
11,2
8,9
100 %
7,3
5,5
8,0
7,1
7,9
6,3
9,0
7,7
8,4
6,8
9,6
8,0
Амплитуды A и V 2,5 В
50 %
9,3
7,9
11,3
8,9
9,5
8,4
11,8
9,1
9,6
8,6
12,1
9,3
100 %
8,5
6,9
9,8
8,2
8,9
7,5
10,7
8,6
9,2
7,9
11,2
8,9
a. Предполагаемое время использования телеметрии ZIP составляет 1 час во время имплантации и 20 минут при
каждом контрольном сеансе раз в три месяца.
b. При стандартном использовании коммуникатора LATITUDE следующим образом: Ежедневный сигнальный запрос
данных On (Вкл), еженедельные дистанционные контрольные сеансы и ежеквартальный запрос данных пациентом.
Сроки службы при настройках «в наихудшем случае» 5,0 В, 500 Ом, 1,0 мс:
70
•
При 70 min-1: 3,2 года для моделей SR и 1,7 года для моделей DR; 2,7 года для моделей DR EL; 3,0
года для моделей VDDR .
•
При 100 min-1: 2.4 года для моделей SR models; 1,1 года для моделей DR; 1,9 года для моделей DR
EL; 2,3 года для моделей VDDR
Сроки службы при LRL (Нижнем пределе частоты) 70 min-1 500 Ом, 0,5 мс, 100 % стимуляции, сенсоры
On (Вкл), и максимальном режиме стимуляции: Модели SR при 2,5 В = 7,9 года, при 5,0 В = 4,7 года;
модели DR при 2,5 В = 6,3 года, при 5,0 В = 2,9 года; модели DR EL при 2,5 В = 8,9 года, при 5,0 В = 4,3
года; модели VDDR при 2,5 В = 7,6 года, при 5,0 В = 4,6 года.
ПРИМЕЧАНИЕ: Энергопотребление, приведенное в таблице со сроками эксплуатации, основано на
теоретических принципах и протестировано исключительно в лабораторных условиях.
Срок службы имплантируемого устройства можно увеличить за счет сокращения следующего:
•
Частота стимуляции
•
Амплитуда стимулирующего импульса (импульсов)
•
Ширина стимулирующего импульса (импульсов)
•
Процентное соотношение событий стимуляции к событиям восприятия
Срок службы аппарата также изменяется при следующих обстоятельствах:
•
При снижении импеданса стимуляции срок службы может уменьшаться.
•
Если МВ-сенсор запрограммирован на Off (Выкл) на весь срок работы аппарата, его срок службы
увеличивается приблизительно на 5 месяцев.
•
Если функция Patient Triggered Monitor (Запускаемый пациентом монитор) запрограммирована на
On (Вкл) в течение 60 дней, то срок службы устройства снижается приблизительно на пять дней.
•
Один дополнительный час телеметрии ZIP Wandless Telemetry снижает срок службы аппарата
приблизительно на девять дней.
71
•
Пять запускаемых пациентом запросов коммуникатору LATITUDE в неделю в течение года снижают
срок службы приблизительно на 14 дней.
•
24 часа в MRI Protection Mode (Режиме защиты при МРТ) (со стимуляцией On (Вкл) снижает срок
службы приблизительно на пять дней.
•
Дополнительные 6 месяцев в режиме Storage (Хранение) до имплантации снижают срок службы
приблизительно на 80 дней. Предполагаемые настройки имплантируемого устройства: 60 min-1LRL,
Amplitude (Амплитуда) стимулирующего импульса — 2,5 В, Pulse Width (Длительность импульса)
стимуляции — 0,4 мс, Impedance (Импеданс) стимуляции — 500 Ом, 100-процентная стимуляция.
На срок службы аппарата могут также влиять следующие факторы:
•
Допустимые отклонения для электрических компонентов
•
Отклонения в программируемых параметрах
•
Отклонения в эксплуатации вследствие состояния пациента
Информацию о расчетном сроке эксплуатации конкретного имплантируемого устройства см. на экране
Summary (Резюме) и Battery Detail (Подробная информация о батарее) системы ПРМ.
ИНФОРМАЦИЯ О ГАРАНТИИ
Сертификат ограниченной гарантии на имплантируемое устройство доступен на сайте www.
bostonscientific.com. За экземпляром сертификата обращайтесь в Boston Scientific — контактная
информация указана на последней странице обложки.
НАДЕЖНОСТЬ ПРОДУКЦИИ
Компания Boston Scientific прилагает максимум усилий для производства имплантируемых устройств
высокого качества и надежности. Тем не менее, в них могут появиться те или иные неисправности, в
результате которых аппарат не сможет проводить необходимую терапию или выполнять ее должным
образом. К таким неисправностям относятся:
72
•
Преждевременный полный разряд батареи
•
Проблемы с детекцией и стимуляцией
•
Сообщения об ошибках
•
Потеря телеметрической связи
Чтобы получить более подробную информацию о работе аппарата, включая виды и частоту
обнаружения неисправностей, которые отмечались у данных аппаратов с момента их создания, см.
отчет CRM Product Performance Report касательно продукции компании Boston Scientific на веб-сайте
www.bostonscientific.com. Хотя ретроспективная информация не всегда может служить подтверждением
надежности работы аппарата в будущем, подобные данные могут оказаться важными для понимания
надежности данного вида продукции в целом.
Иногда неисправности аппарата могут привести к выпуску информационных бюллетеней.
Boston Scientific определяет необходимость выпуска подобных бюллетеней исходя из оценки частоты
обнаружения неисправности и ее клинических последствий. Когда Boston Scientific распространяет
подобного рода информацию, при принятии решения о замене аппарата должны учитываться риски,
связанные с неисправностями и процедурой замены, а также имеющиеся на сегодняшний день данные о
надежности работы аппарата для замены.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Указанные ниже темы подлежат обсуждению с пациентом перед выпиской.
•
Наружная дефибрилляция.Если пациенту выполнялась наружная дефибрилляция, ему следует
связаться со своим врачом для проверки имплантированного устройства
•
Признаки и симптомы инфекции
•
Симптомы, о которых следует сообщать (например, стимуляция высокой частоты, требующая
перепрограммирования)
73
•
Охраняемая среда—перед тем, как войти в помещения с предостережением о запрете на вход
лицам с имплантируемым устройством, пациент должен получить медицинские рекомендации
•
Выполнение МРТ — необходимо проконсультироваться с лечащим кардиологом пациента, чтобы
оценить возможность проведения МРТ
•
Избегайте источников потенциального электромагнитного воздействия дома, на работе и в
лечебных учреждениях
•
Надежность имплантируемого устройства ("Надежность продукции" на странице 72)
•
Ограничения деятельности (если применимо)
•
Минимальная частота сердечных сокращений (низкий предел частоты в имплантируемом
устройстве)
•
Частота проведения контрольных сеансов
•
Путешествие или переезд—если пациент собирается покинуть страну, в которой проводилась
имплантация, следует заранее организовать проведение контрольных сеансов
•
Идентификационная карта пациента—данная карта входит в комплект аппарата, и пациенту
следует порекомендовать всегда носить ее с собой
ПРИМЕЧАНИЕ: Перед входом в защищенные помещения (например, для прохождения МРТ)
пациенты должны предъявлять свою идентификационную карту.
Руководство для пациента
Пациент, его родственники и другие заинтересованные лица могут получить экземпляр Руководства для
пациента.
Чтобы заинтересованные лица полностью познакомились с работой имплантируемого устройства,
рекомендуется обсудить с ними информацию, содержащуюся в Руководстве пациента, как до, так и
после имплантации.
74
Кроме того, пациенты с МР-условно безопасной системой стимуляции ImageReady могут получить
Руководство пациента по МРТ.
За дополнительными экземплярами сертификата обращайтесь в Boston Scientific — контактная
информация указана на последней странице обложки.
СОЕДИНЕНИЯ ЭЛЕКТРОДОВ
Ниже приведены соединения электродов.
ПРЕДУПРЕЖДЕНИЕ: Перед имплантацией убедитесь в совместимости электрода и имплантируемого
устройства. Использование несовместимых электродов и имплантируемых устройств может повредить
коннектор и/или привести к возможным неблагоприятным последствиям, таким как недостаточное
восприятие сердечных сигналов или невозможность проведения необходимой терапии.
ПРИМЕЧАНИЕ: Чтобы имплантированная система считалась МР-условно безопасной, необходимо
использовать МР-условно безопасные электроды Boston Scientific. Номера моделей имплантируемых
устройств, электродов, принадлежностей и других компонентов системы, необходимых для
выполнения условий использования, см. в техническом руководстве по МРТ.
ПРЕДУПРЕЖДЕНИЕ: Если параметр Lead Configuration (Конфигурация электрода) запрограммирован
на значение Bipolar (Биполярный) при установленном монополярном электроде, стимуляция
выполняться не будет.
Ниже приведены соединения электродов, применяемые к аппаратам ACCOLADE, PROPONENT,
ESSENTIO и ALTRUA 2.
75
[1] RA (ПП)/RV (ПЖ) Белый [2] RA (ПП)/RV (ПЖ) [3] Шовное отверстие
Рисунок 2. Соединения электродов и местоположение зажимного винта, RA (ПП)/RV (ПЖ): IS-1
76
[1] RA (ПП): Белый [2] RV (ПЖ): Белый [3] RA (ПП) [4] RV (ПЖ) [5] Шовное отверстие
Рисунок 3. Соединения электродов и местоположение зажимного винта, RA (ПП): IS-1; RV (ПЖ):
IS-1
Ниже приведены соединения электродов, применяемые к аппаратам FORMIO, VITALIO, INGENIO и
ADVANTIO.
77
[1] RA (ПП)/RV (ПЖ) [2] Шовное отверстие
Рисунок 4. Соединения электродов и местоположение зажимного винта, RA (ПП)/RV (ПЖ): IS1
[1] RA (ПП) [2] RV (ПЖ) [3] Шовное отверстие
Рисунок 5. Соединения электродов и местоположение зажимного винта, RA (ПП): IS-1, RV (ПЖ):
IS-1
ПРИМЕЧАНИЕ: Корпус имплантируемого устройства используется в качестве стимулирующего
полюса, если имплантируемое устройство было запрограммировано на установку монополярного
электрода.
78
ИМПЛАНТАЦИЯ ИМПЛАНТИРУЕМОГО УСТРОЙСТВА
Проведите имплантацию имплантируемого устройства, выполнив следующие шаги в указанной
последовательности. Некоторым пациентам сразу после подсоединения электродов к имплантируемому
устройству может потребоваться стимулирующая терапия. Если необходимо изменить номинальные
параметры, рекомендуется произвести программирование имплантируемого устройства до
имплантации системы электродов или в процессе их имплантации и формирования имплантационного
«кармана».
ПРЕДОСТЕРЕЖЕНИЕ: Имплантацию системы нельзя проводить в зоне III (и выше) учреждения, где
проводится МРТ, согласно определению методического документа по технике безопасности при МР-
процедурах Американского колледжа радиологии (American College of Radiology Guidance Document for
Safe MR Practices)6 Некоторые принадлежности, поставляемые в комплекте с имплантируемыми
устройствами и электродами, в т. ч. отвертка и стилетные провода, не являются МР-условно
безопасными, и их нельзя приносить в палату проведения МРТ, комнату управления и зоны III или IV
МРТ.
Шаг A: Проверьте оборудование
В ходе имплантации рекомендуется иметь в распоряжении средства для кардиомониторинга,
дефибрилляции и измерения электродных импульсов. К таким средствам относится система ПРМ с
соответствующими принадлежностями и программное обеспечение. Перед началом имплантации
полностью ознакомьтесь с работой всего оборудования и информацией, содержащейся в руководствах
пользователя и оператора. Проверьте рабочее состояние всего оборудования, которое, возможно, будет
использоваться при проведении процедуры. В случае случайного повреждения или заражения
необходимо иметь в распоряжении указанные ниже принадлежности:
•
Стерильные дубликаты всех имплантируемых частей
•
Стерильную головку
6.
Kanal E, et al., American Journal of Roentgenology 188:1447-74, 2007.
79
•
Стерильные кабели анализатора системы стимуляции
•
Отвертки с моментом и без
В ходе имплантации необходимо иметь в распоряжении стандартный трансторакальный дефибриллятор
с внешними плоскими электродами или электродами с прокладками.
Шаг B: Запросить данные с имплантируемого устройства и проверить его
Прежде чем вскрыть стерильную блистерную упаковку, для сохранения стерильности протестируйте
имплантируемое устройство, как описано ниже. Для точности измеряемых параметров имплантируемое
устройство должно находиться при комнатной температуре.
1.
Отправьте запрос имплантируемому устройству с помощью системы ПРМ. Убедитесь в том, что
Device Mode (Режим аппарата) имплантируемого устройства находится в состоянии Storage
(Хранение). Если это не так, свяжитесь с компанией Boston Scientific (контактная информация
указана на последней странице обложки).
Для начала сеанса ZIP-телеметрии для аппаратов ACCOLADE, PROPONENT и ESSENTIO
убедитесь, что беспроводной радиопередатчик ZOOM подключен к ПРМ с помощью USB-кабеля и
горит зеленый индикатор в верхней части передатчика. Для начала связи со всеми приборами
установите головку над PG и используйте ПРМ для запроса имплантируемого устройства.
Удерживайте телеметрическую головку в необходимом положении до тех пор, пока не появится
сообщение о том, что ее можно убрать из непосредственной близости от имплантируемого
устройства, либо пока не загорится индикатор ZIP-телеметрии на системе ПРМ. Для завершения
сеанса телеметрии и возврата к начальному экрану, нажмите на кнопку End Session (Завершить
сеанс). РЧ-помехи могут временно нарушать телеметрическую связь ZIP. Удаление от источника
помех или изменение положения беспроводного радиопередатчика ZOOM Wireless Transmitter
может улучшить работу ZIP-телеметрии. Если качество ZIP-телеметрии неудовлетворительно,
возможно использование телеметрической головки.
2.
Проверьте текущий статус батареи имплантируемого устройства. Счетчики должны быть обнулены.
Не проводите имплантацию устройства, если батарея имплантируемого устройства заряжена не на
80
полную мощность. Свяжитесь с компанией Boston Scientific (контактная информация указана на
последней странице обложки).
3.
Если во время имплантации необходима монополярная стимулирующая конфигурация,
запрограммируйте Unipolar (Монополярную) Lead Configuration (Конфигурацию электрода) до
начала процедуры.
Шаг C: Имплантация системы электродов
Для восприятия и стимуляции имплантируемому устройству требуется система электродов.
Выбор конфигурации электродов и конкретных хирургических процедур является прерогативой
медицинского персонала. В зависимости от модели аппарата с имплантируемым устройством можно
использовать указанные далее электроды.
•
Монополярный или биполярный предсердный электрод
•
Монополярный или биполярный правый желудочковый электрод.
ПРИМЕЧАНИЕ: Однокамерные аппараты можно использовать с предсердным или с желудочковым
электродом.
ПРИМЕЧАНИЕ: При использовании биполярных стимулирующих электродов снизится вероятность
восприятия миопотенциальных помех.
ПРИМЕЧАНИЕ: Использование монополярного электрода с имплантируемым устройством
ImageReady противоречит Условиям использования, необходимым для МР-условно безопасного
статуса. Предостережения, меры предосторожности и другую информацию об МРТ см. в
Техническом руководстве по МРТ.
81
ПРИМЕЧАНИЕ: Чтобы имплантированная система считалась МР-условно безопасной, необходимо
использовать МР-условно безопасные электроды Boston Scientific. Номера моделей имплантируемых
устройств, электродов, принадлежностей и других компонентов системы, необходимых для
выполнения Условий использования МРТ, а также предостережения и меры предосторожности при
проведении МРТ см. в Техническом руководстве по МРТ.
ПРЕДУПРЕЖДЕНИЕ: Отсутствие электрода или заглушки в порте для электрода может повлиять на
работу аппарата. Если электрод не используется, должным образом вставьте в неиспользуемый порт
заглушку, а затем затяните фиксирующий винт на заглушке.
ПРЕДУПРЕЖДЕНИЕ: Если режим работы двухкамерного аппарата установлен на AAI(R), убедитесь
в наличии функционирующего электрода RV (ПЖ). При отсутствии функционирующего электрода RV
(ПЖ) установка режима работы на AAI(R) может привести к недостаточной или избыточной детекции.
ПРЕДУПРЕЖДЕНИЕ: Не накладывайте швы непосредственно над телом электрода. Это может
привести к его повреждению. Чтобы предотвратить смещение электрода, закрепите его проксимальный
конец в месте входа в вену, используя при этом фиксирующую муфту.
Выполните имплантацию электродов с использованием выбранного хирургического способа.
При замене ранее вживленного имплантируемого устройства может понадобиться переходник для
подсоединения нового имплантируемого устройства к уже установленным электродам. При
использовании переходника придерживайтесь процедуры подсоединения аппарата, описанной в
соответствующей спецификации переходника. Прежде чем подсоединить переходник к
имплантируемому устройству, всегда подсоединяйте переходник к электроду и проводите повторные
измерения порога и восприятия.
ПРИМЕЧАНИЕ: Если в функционировании электрода произошли изменения, неустранимые
программными способами, то в случае отсутствия адаптера электрод придется заменить.
82
ПРИМЕЧАНИЕ: Использование переходников противоречит Условиям использования, необходимым
для МР-условно безопасного статуса. Предостережения, меры предосторожности и другую
информацию об МРТ см. в Техническом руководстве МРТ.
Шаг D: Выполните базовые измерения
После имплантации электродов выполните базовые измерения. Оцените подаваемые на электроды
импульсы. При замене имплантируемого устройства необходимо повторно оценить существующие
электроды (например, амплитуду импульсов, пороги стимуляции и сопротивление). Для оценки
положения электродов и их целостности можно использовать рентгенографию. При
неудовлетворительных результатах тестирования может потребоваться изменение положения системы
электродов или ее замена.
•
Подсоедините стимулирующий/воспринимающий электрод (электроды) к анализатору системы
стимуляции (PSA).
•
Ниже приведены измерения стимулирующего/воспринимающего электрода, выполняемые
приблизительно через 10 минут после его изначального размещения (при неотложном состоянии)
или во время процедуры замены (при хроническом состоянии). Значения, не предложенные в
таблице, могут быть клинически приемлемыми, если можно записать соответствующее восприятие
с текущими программируемыми значениями. Если наблюдаются отклонения в восприятии,
перепрограммируйте параметр чувствительности. Примите во внимание, что вследствие
фильтрации импульсов измерения имплантируемого устройства могут не совпадать с
измерениями анализатора систем стимуляции.
83

Таблица 23. Показания электрода
Стимулирующий/
Стимулирующий/
воспринимающий электрод
воспринимающий электрод
(при неотложном состоянии)
(при хроническом состоянии)
R-Wave Amplitudeab
> 5 мВ
> 5 мВ
(Амплитуда зубца R)
P-Wave Amplitudeab
> 1,5 мВ
> 1,5 мВ
(Амплитуда зубца P)
R-WaveDurationbcd
< 100 мс
< 100 мс
(Длительность зубца R)
Pacing Threshold (Порог
< 1,5 В эндокардиальный
< 3,0 В эндокардиальный
стимуляции) (правый
< 2,0 В эпикардиальный
< 3,5 В эпикардиальный
желудочек)
84

Таблица 23. Показания электрода (продолжение)
Стимулирующий/
Стимулирующий/
воспринимающий электрод
воспринимающий электрод
(при неотложном состоянии)
(при хроническом состоянии)
Pacing Threshold (Порог
< 1,5 В эндокардиальный
< 3,0 В эндокардиальный
стимуляции) (предсердие)
Сопротивление электродов
> запрограммированное
> запрограммированное
(предсердия и правого
значение Low (Нижний)
значение Low (Нижний)
желудочка при 5,0 В и 0,5 мс)
предела импеданса (200-500
предела импеданса (200-500
Ом)
Ом)
< 2000 Ом (или
< 2000 Ом (или
запрограммированное
запрограммированное
значение High (Верхний)
значение High (Верхний)
предела импеданса (2000-3000
предела импеданса (2000-3000
Ом))
Ом))
a. При хронических состояниях и амплитуде менее 2 мВ подсчет частоты сердечных сокращений будет неточным,
детекция тахиаритмии невозможна, а нормальный сердечный ритм может быть распознан как аномальный
b. Причиной слабой амплитуды и большей продолжительности R-волны может быть расположение электродов в ткани с
рубцами или ишемией. Поскольку качество импульсов в данных случаях сильно понижается, необходимо
предпринять меры по соблюдению указанных выше критериев и изменить положение электродов для получения
наиболее сильной из возможных амплитуд с самой короткой продолжительностью.
c. Продолжительность более 135 мс (рефракторный период имплантируемого устройства) может привести к неточному
определению частоты сердечных сокращений, невозможности детекции тахиаритмии или неверной интерпретации
нормального сердечного ритма как аномального.
d. Данное измерение не включает ток повреждения.
85
Если целостность электрода вызывает сомнения, то для оценки целостности системы электрода следует
выполнить стандартные тесты поиска и устранения неисправностей электрода. Тесты поиска и
устранения неисправностей включают в себя, в том числе, следующие:
•
Анализ электрограммы с манипуляциями с «карманом»
•
Анализ рентгенографического или рентгеноскопического изображения
•
Инвазивный осмотр
Шаг E: Сформируйте имплантационный «карман»
Используя стандартные операционные процедуры, подготовьте имплантационный «карман». Выберите
месторасположение «кармана» исходя из конфигурации имплантируемых электродов и конституции
пациента. Учитывая анатомию пациента, размер имплантируемого устройства и его подвижность,
осторожно скрутите избыток электрода и поместите его вблизи имплантируемого устройства. Важно
поместить электрод в ложе аппарата таким образом, чтобы минимизировать натяжение электрода, его
перекручивание, образование острых углов и/или давление. Для минимального травмирования ткани и
облегчения процесса деимплантации имплантируемые устройства обычно имплантируют подкожно.
Однако у некоторых пациентов имплантация устройства в более глубокие слои ткани (например, под
грудной мышцей) может помочь избежать эрозии или выпячивания аппарата.
Если проводится абдоминальная имплантация, рекомендуется проводить ее с левой стороны брюшной
полости.
ПРИМЕЧАНИЕ: Абдоминальная имплантация противоречит Условиям использования для МР-
условно безопасного статуса. Предостережения, меры предосторожности и другую информацию об
МРТ см. в Техническом руководстве по МРТ.
Если необходимо провести электрод через полость, примите во внимание следующее:
86
•
Если совместимый троакар не применяется, наденьте на концевые штыри электрода колпачки. Для
проведения электродов могут использоваться дренажная трубка Пенроуза, большая плевральная
дренажная трубка или проводящий инструмент.
•
При необходимости осторожно проведите электроды под кожей к имплантационному «карману».
•
Выполните повторную оценку импульсов всех электродов, чтобы определить, не повредились ли
электроды во время установки.
Если при имплантации электродов они не подключены к имплантируемому устройству, то перед
закрытием разреза на них должны быть надеты колпачки.
Шаг F: Подсоедините электроды к имплантируемому устройству
Для присоединения электродов к имплантируемому устройству необходимо использовать только
инструментарий, находящийся на стерильном лотке имплантируемого устройства или в комплекте
принадлежностей к нему. Во избежание повреждения зажимных винтов, уплотняющих заглушек или
резьбовых соединений коннектора всегда используйте только поставляемую в комплекте отвертку. Не
производите имплантацию устройства, если уплотняющие заглушки повреждены. Держите под рукой все
инструменты до тех пор, пока не будут закончены все процедуры тестирования и имплантация
устройства.
Автоматическое обнаружение электрода
До обнаружения электрода правого желудочка или другого соответствующего электрода в однокамерном
аппарате импеданс электрода будет измеряться в монополярной и биполярной конфигурациях. После
ввода электрода в головку контур измерения импеданса выявит импеданс, указывающий, что аппарат
имплантирован (автоматическое обнаружение электрода). Если импеданс устанавливается в диапазоне
(200-2000 Ω, включительно), имплантируемое устройство автоматически переключится на номинальные
параметры и запустит детекцию и выполнение терапии. Кроме того, имплантируемое устройство можно
запрограммировать на выход из режима Storage (Хранение) перед имплантацией, с помощью системы
ПРМ.
87
ПРИМЕЧАНИЕ: Если используемый для автоматического обнаружения электрод монополярный,
импеданс в пределах диапазона не будет получен, пока не установится стабильный контакт между
имплантируемым устройством и подкожной тканью «кармана».
ПРИМЕЧАНИЕ: Arrhythmia Logbook (Журнал регистрации аритмий) и данные сохраненных
электрограмм не будут сохраняться в течение первых двух часов после обнаружения электрода (за
исключением эпизодов PaceSafe и эпизодов, запущенных пациентом).
Если аппарат запрограммирован на выход из режима Storage (Хранение), перед вводом биполярного
электрода ПЖ или перед установкой имплантируемого устройства в подкожный «карман», если
используется монополярный электрод ПЖ, на внутрисердечных электрокардиограммах можно
наблюдать асинхронные стимулирующие импульсы. Эти подпороговые импульсы не будут возникать при
обнаружении в головке биполярного электрода ПЖ или в случае, если при контакте корпуса
кардиостимулятора и подкожной ткани замыкается нормальный контур стимуляции для монополярного
электрода ПЖ. Если режим Storage (Хранение) отключается в результате автоматического обнаружения
электрода, то, чтобы запустить стимуляцию после обнаружения электрода, имплантируемому
устройству может понадобиться до 2 секунд плюс один интервал LRL.
Электроды следует подсоединять к имплантируемому устройству в указанной ниже последовательности
(расположение головки имплантируемого устройства и зажимного винта см. на рис. в "Соединения
электродов" на странице 75):
ПРИМЕЧАНИЕ: Для однокамерных аппаратов используйте электрод ПП или ПЖ, по
необходимости.
1.
Правый желудочек. Сначала подсоедините электрод ПЖ, поскольку это необходимо для
настройки временных циклов на основе ПЖ, которые выполняют адекватные детекцию и
стимуляцию во всех камерах сердца вне зависимости от запрограммированной конфигурации.
ПРИМЕЧАНИЕ: Для автоматического обнаружения электрода затяжка зажимного винта RV
(ПЖ) не требуется, но ее следует выполнять для обеспечения полного электрического
контакта.
88
•
В моделях с портом для ПЖ-электрода IS-1, вставьте и зафиксируйте концевой штырь
стимулирующего/воспринимающего ПЖ-электрода IS-1.
2.
Правое предсердие.
•
В моделях с портом для ПП-электрода IS-1 вставьте и зафиксируйте концевой штырь
предсердного стимулирующего/воспринимающего электрода IS-1.
Подсоедините каждый электрод к имплантируемому устройству, придерживаясь указанных далее шагов
(дополнительную информацию об отвертке см. в "Двусторонний ключ с регулируемым торсионным
моментом" на странице 96):
1.
Проверьте присутствие крови или биологических жидкостей организма в портах электродов на
головке имплантируемого устройства. Если в порты случайно попала какая-либо жидкость,
тщательно очистите их стерильной водой.
2.
При наличии защитного устройства на кончике перед тем, как воспользоваться отверткой, удалите
и утилизируйте его.
3.
Аккуратно вставьте стержень отвертки в зажимной винт, пропуская его через щелевое центральное
углубление в уплотняющей заглушке под углом 90° (Рисунок 6 Размещение ключа на странице 90).
Уплотняющая заглушка при этом откроется, сбрасывая возможное накопленное давление из порта
для электрода за счет образования канала для сброса скопившихся жидкости или воздуха.
ПРИМЕЧАНИЕ: Неправильная установка отвертки в щелевом углублении уплотняющей
заглушки может привести к повреждению втулки и нарушению ее герметизирующей функции.
ПРЕДУПРЕЖДЕНИЕ: Для правильного введения электрода в коннектор имплантируемого
устройства соблюдайте следующие меры предосторожности.
•
Для выпускания скопившейся жидкости или воздуха вставьте отвертку в щелевое углубление
уплотняющей заглушки перед тем, как вставить электрод в порт.
89

•
Убедитесь, что фиксирующий винт достаточно выкручен, чтобы вставить электрод. При
необходимости ослабьте винт при помощи отвертки.
•
Полностью введите электрод в порт, а затем закрутите фиксирующий винт на концевом
штыре электрода.
Рисунок 6. Размещение ключа
4.
Не вынимая отвертку, вставьте кончик электрода в порт для электрода до упора. Если смотреть на
концевой штырь электрода со стороны головки имплантируемого устройства EasyView, он должен
четко просматриваться за блоком коннектора. Надавите на электрод для надежной фиксации его
положения и убедитесь, что он полностью вставлен в порт для электрода.
ПРЕДУПРЕЖДЕНИЕ: Введите концевую часть электрода непосредственно в порт для
электрода. Не перегибайте электрод возле соединения электрода с головкой. Неправильное
введение электрода может привести к повреждению его изоляции или коннектора.
ПРИМЕЧАНИЕ: При необходимости для облегчения введения электродов в качестве смазки их
коннекторов используйте небольшое количество стерильной воды.
90
ПРИМЕЧАНИЕ: Для электродов IS-1; убедитесь, что концевой штырь выступает за блок
коннектора, по крайней мере, на 1 мм.
5.
Слегка надавливая на отвертку, вставляйте ее до тех пор, пока стержень полностью не войдет в
полость зажимного винта, следя при этом за тем, чтобы не повредить уплотняющую заглушку.
Затяните зажимной винт, медленно поворачивая отвертку по часовой стрелке, пока она не щелкнет
один раз. Отвертка сконструирована таким образом, чтобы прилагать необходимое усилие к
зажимному винту.Дополнительное вращение и усилие не требуются.
6.
Удалите отвертку.
7.
Осторожно потяните за электрод, чтобы проверить надежность его фиксации.
8.
Если кончик электрода не закреплен, попробуйте открутить зажимной винт и снова закрутить.
Снова вставьте отвертку описанным выше способом и ослабьте зажимной винт, медленно
поворачивая отвертку против часовой стрелки до тех пор, пока электрод не освободится. Затем
повторите действия в указанной выше последовательности.
9.
Если порт электрода не используется, вставьте заглушку в неиспользуемый порт и закрутите
зажимной винт.
ПРЕДУПРЕЖДЕНИЕ: Отсутствие электрода или заглушки в порте для электрода может
повлиять на работу аппарата. Если электрод не используется, должным образом вставьте в
неиспользуемый порт заглушку, а затем затяните фиксирующий винт на заглушке.
Шаг G: Оцените импульсы электродов
1.
Вставьте имплантируемое устройство в имплантационный «карман».
2.
Оцените импульсы стимулирующего/воспринимающего электрода, проводя ЭКГ-мониторинг в
режиме реального времени и просматривая маркеры. Показания электрода должны отражать
указанные выше (Таблица 23 Показания электрода на странице 84).
91
В зависимости от собственного сердечного ритма пациента, возможно, придется временно
отрегулировать параметры стимуляции таким образом, чтобы иметь возможность оценивать
стимуляцию и восприятие. Если стимуляция и/или восприятие не на должном уровне, отсоедините
электрод от имплантируемого устройства и осмотрите коннектор и электроды. При необходимости
проведите повторное тестирование электрода.
ПРЕДУПРЕЖДЕНИЕ: Следите за тем, чтобы артефакты, исходящие из желудочков, отсутствовали на
предсердном канале, в противном случае может произойти излишнее восприятие предсердных сигналов
(oversensing). Если желудочковые артефакты все же присутствуют на предсердном канале, возможно,
необходимо изменить положение предсердного электрода, чтобы свести к минимуму это
взаимодействие.
3.
Оцените импедансы всех электродов.
Для аппаратов ACCOLADE, PROPONENT, ESSENTIO и ALTRUA 2 High (Верхнее) предельное значение
импеданса составляет 2000 Ом. Программируемая величина может принимать значения от 2000 до 3000
Ом с шагом 250 Ом. Номинальное значение Low (Нижний) для предела импеданса равно 200 Ом. Этот
параметр можно запрограммировать в диапазоне от 200 до 500 Ом с шагом 50 Ом.
Для аппаратов FORMIO, VITALIO, INGENIO и ADVANTIO High (Верхний) предел импеданса
зафиксирован на уровне 2000 Ом. Номинальное значение Low (Нижний) для предела импеданса равно
200 Ом. Этот параметр можно запрограммировать в диапазоне от 200 до 500 Ом с шагом 50 Ом.
При выборе Impedance Limits (Предельных значений импеданса) необходимого учитывать следующие
факторы:
•
Предыдущие измерения импеданса давно имплантированного электрода, а также другие
показатели электрических характеристик, такие как стабильность во времени
•
Начальное измеренное значение импеданса недавно имплантированных электродов
92
ПРИМЕЧАНИЕ: В зависимости от наличия симптомов старения электрода, при последующем
тестирование после завершения терапии, врач может перепрограммировать пределы импеданса.
•
Зависимость пациента от стимуляции
•
Рекомендуемый диапазон импеданса для используемого электрода (электродов) (если доступен)
Шаг H: Выполните программирование имплантируемого устройства
1.
Проверьте Programmer Clock (Часы программатора), при необходимости, настройте и
синхронизируйте имплантируемое устройство, чтобы на распечатываемых отчетах и записях
линейных диаграмм системы ПРМ было указано правильное время.
2.
Если порт (порты) электрода не используются, учитывайте это при программировании
имплантируемого устройства.
При программировании имплантируемого устройства необходимого учитывать следующие факторы:
•
Для каждой камеры рекомендуется соблюдать как минимум двукратный запас по напряжению и
трехкратный запас по ширине импульса, что обеспечит необходимую надежность и продлит срок
службы батареи.
•
Программирование более длительного периода гашения может повысить вероятность
недостаточного восприятия зубцов R.
•
Программирование более короткого периода гашения может приводить к увеличению вероятности
чрезмерного желудочкового восприятия стимулированного предсердного события.
•
При программировании MTR (Максимальной частоты отслеживания) учитывается клиническая
картина, возраст, общее состояние пациента, функция синусового узла и что высокое значение
MTR может быть неприемлемым для пациентов со стенокардией или другими симптомами ишемии
миокарда при более высоких частотах.
93
•
При программировании MTR (Максимальной частоты отслеживания) учитывается клиническая
картина, возраст, общее состояние пациента и что частотно-адаптивная стимуляция с повышенной
частотой может быть неприемлемым для пациентов со стенокардией или другими симптомами
ишемии миокарда при таких высоких частотах. Следует выбирать адекватное значение MSR на
основании оценки наибольшей частоты стимуляции, которую пациент может перенести
удовлетворительно
•
Программирование длительных Atrial Refractory (Предсердных рефрактерных) периодов в
сочетании с определенными периодами AV Delay (AV-задержки) может привести к внезапной
блокаде 2:1 на запрограммированной MTR (Максимальной частоте отслеживания).
•
Перед программированием включения RVAC рассмотрите целесообразность управляемого
автоматического определения захвата для желудочка, чтобы убедиться, что функция будет
работать в соответствии с ожиданиями.
•
Для зависимых от кардиостимулятора пациентов или с монополярными запрограммированными
электродами рассмотрите использование восприятия Fixed Sensing (С фиксированным порогом)
вместо восприятия AGC (С АРУ).
•
У пациентов, зависимых от кардиостимулятора, соблюдайте осторожность при планировании
настроек Noise Response (Ответа на шум) с целью Inhibit Pacing (Блокировки стимуляции),
поскольку стимуляция не будет происходить при наличии шума.
•
Для прекращения предполагаемого взаимодействия с MV (МВ-) сенсором, установите его в
положение Off (Выкл).
Шаг I: Имплантирование имплантируемого устройства
1.
Проверьте функцию магнита и телеметрической связи, чтобы убедиться в должном
функционировании имплантируемого устройства для начала опроса.
2.
Убедитесь, что имплантируемое устройство имеет хороший контакт с окружающей тканью
имплантационного кармана, а затем, чтобы минимизировать миграцию устройства, пришейте
94
аппарат (местоположение шовных отверстий см. на рис. в "Соединения электродов" на странице
75). Аккуратно сверните лишнюю длину электрода и разместите рядом с имплантируемым
устройством. При необходимости, чтобы избежать высушивания «кармана», промойте его
физиологическим раствором.
ПРЕДОСТЕРЕЖЕНИЕ: Не скручивайте, не сгибайте электрод и не обвивайте его другими
электродами, поскольку это может привести к абразивному повреждению изоляции электрода или
повреждению проводника.
3.
Закройте имплантационный «карман». Необходимо размещать электроды таким образом, чтобы
они не вступали в контакт с шовным материалом. Для ушивания слоев ткани рекомендуется
использовать рассасывающийся шовный материал.
4.
Если во время процедуры имплантации использовался режим Electrocautery
(Электрокаутеризация), отмените его по завершении.
5.
Подтвердите окончательные запрограммированные параметры.
ПРЕДУПРЕЖДЕНИЕ: После любой регулировки параметра Sensitivity (Чувствительность) или
любой модификации воспринимающего электрода всегда проверяйте адекватность восприятия
сигналов. Программирование параметра Sensitivity (Чувствительность) на самое высокое значение
(самая низкая чувствительность) может привести к задержке обнаружения тахикардии или
недовосприятию (undersensing) сердечной активности. Аналогичным образом, минимальное
значение чувствительности (максимальная чувствительность) может привести к избыточному
восприятию сигналов, идущих не от сердца.
6.
Распечатайте отчеты о параметрах из системы ПРМ и сохраните все данные пациента.
Шаг J: Заполните и отправьте Форму об имплантации
В течение десяти дней с момента имплантации заполните форму подтверждения гарантии и
регистрации электродов и отправьте ее оригинал в компанию Boston Scientific вместе с копией данных
пациента, сохраненных в ПРМ. Благодаря этой информации, компания Boston Scientific сможет
95
зарегистрировать каждое вживленное имплантируемое устройство и комплект электродов, а также
предоставить клинические данные о функционировании имплантированной системы. В истории болезни
пациента сохраните экземпляр формы подтверждения гарантии и регистрации электродов, распечатки
программатора и оригинальные данные пациента.
ДВУСТОРОННИЙ КЛЮЧ С РЕГУЛИРУЕМЫМ ТОРСИОННЫМ МОМЕНТОМ
Отвертка (модель 6628) находится в стерильном лотке, поставляемом с имплантируемым устройством,
и предназначена для затягивания и ослабления зажимных винтов № 2-56, зажимных винтов с захватом и
прочих зажимных винтов на этом и других имплантируемых устройствах компании Boston Scientific. Эта
отвертка может также использоваться для работы с принадлежностями для электродов, которые имеют
зажимные винты, свободно вращающиеся при полном закручивании (обычно у таких зажимных винтов
есть белые уплотняющие заглушки).
Данный ключ является двусторонним и отрегулирован таким образом, чтобы к зажимному винту
прилагался правильный момент затяжки. Когда зажимной винт будет хорошо затянут, ключ застопорится.
Механизм высвобождения стопора препятствует чрезмерному затягиванию винта, что могло бы
повредить аппарат. Для облегчения выкручивания сильно затянутых зажимных винтов момент затяжки в
направлении против часовой стрелки больше, чем по часовой стрелке.
ПРИМЕЧАНИЕ: В качестве дополнительного предохранительного средства кончик ключа
сконструирован таким образом, что при излишнем затягивании, превышающем допустимый
уровень, он ломается. В таком случае сломанный кончик необходимо извлечь из зажимного винта при
помощи пинцета.
Эту отвертку также можно использовать для ослабления зажимных винтов других имплантируемых
устройств компании Boston Scientific, а также принадлежностей для электродов с зажимными винтами,
которые затягиваются до упора при полном выкручивании (обычно у таких зажимных винтов есть
прозрачные уплотняющие заглушки). Тем не менее, при закручивании данных зажимных винтов
прекратите поворачивать ключ, когда зажимной винт застопорится. Если зажимные винты затягиваются
96
против стопора, дополнительный поворот отвертки против часовой стрелки может привести к тому, что
они застрянут.
Ослабление застрявших зажимных винтов
Чтобы ослабить застрявший зажимной винт, выполните приведенные ниже действия.
1.
Из перпендикулярного положения отклоните отвертку в сторону на 20-30º от вертикальной
центральной оси зажимного винта (Рисунок 7 Вращение отвертки для ослабления застрявшего
зажимного винта на странице 98).
2.
Три раза поверните отвертку вокруг оси по часовой стрелке (для закрученного винта) или против
нее (для выкрученного винта) так, чтобы рукоятка отвертки вращалась с центральной линией винта
(Рисунок 7 Вращение отвертки для ослабления застрявшего зажимного винта на странице 98).
Рукоятка ключа не должна поворачиваться во время этого вращения.
3.
При необходимости это действие можно повторить до четырех раз, каждый раз слегка увеличивая
угол наклона. Если не удается полностью освободить зажимной винт, используйте ключ № 2 из
набора гаечных ключей модели 6501.
4.
После ослабления зажимного винта его можно выдвинуть или задвинуть по необходимости.
5.
Утилизируйте ключ после завершения работы.
97
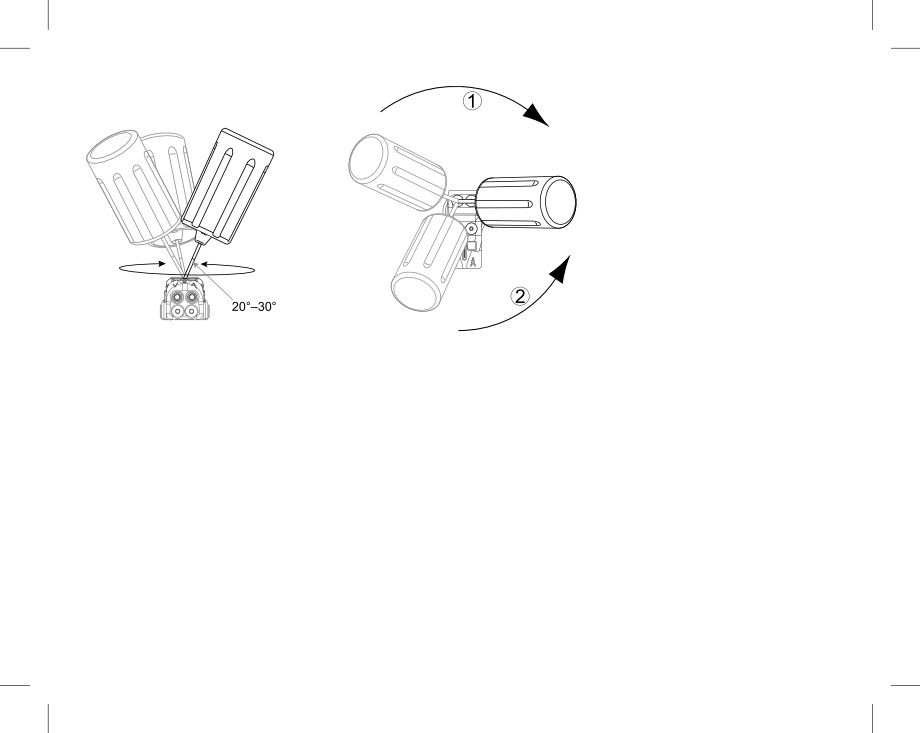
[1] Вращение по часовой стрелке для высвобождения зажимных винтов, застрявших в закрученном
положении [2] Вращение против часовой стрелки для высвобождения зажимных винтов, застрявших в
выдвинутом положении
Рисунок 7. Вращение отвертки для ослабления застрявшего зажимного винта
ТЕСТИРОВАНИЕ ПОСЛЕ ЗАВЕРШЕНИЯ ТЕРАПИИ
Оценку функциональности аппарата с периодическим контрольным тестированием рекомендуется
проводить обученному персоналу. Указанное ниже руководство по контрольной проверке даст
возможность выполнить полный анализ характеристик аппарата и соответствующего состояния
здоровья пациента в течение всего срока службы аппарата.
98
Наблюдение перед выпиской
Указанные ниже процедуры обычно выполняются с использованием телеметрии системы ПРМ во время
наблюдения перед выпиской:
1.
Опросите имплантированное устройство и просмотрите экран Summary (Резюме).
2.
Проверьте пороги стимуляции, импеданс электродов и амплитуду собственных импульсов
пациента.
3.
Проверьте счетчики и просмотрите гистограммы.
4.
После завершения всех тестов выполните окончательный опрос устройства и сохраните все
данные пациента.
5.
Распечатайте Quick Notes (Краткий справочник) и Patient Data (Данные пациента) и сохраните их
для использования в будущем в справочных целях.
6.
Обнулите счетчики и очистите гистограммы таким образом, чтобы во время следующего
контрольного сеанса отображались только самые актуальные данные. Обнулить счетчики и
очистить гистограммы возможно путем нажатия кнопки Reset (Сброс) на экранах Histogram
(Гистограмма), Tachy Counters (Счетчики тахиаритмий) или Brady Counters (Счетчики брадикардий).
Обычное наблюдение
В начале и в середине срока службы аппарата мониторинг его рабочих характеристик рекомендуется
выполнять посредством обычного наблюдения через один месяц после осмотра пациента перед
выпиской и далее не менее раза в год. Визиты в лечебное учреждение могут сопровождаться
удаленным мониторингом (если доступен). Как и всегда, чтобы установить наиболее подходящий график
наблюдения, врач обязан оценить текущее состояние здоровья пациента, состояние и значения
параметров аппарата, а также учесть местные медицинские нормы.
99
Если аппарат достигает статуса One Year Remaining (Остался один год) и/или Magnet Rate (Магнитная
частота) составляет 90 min-1, наблюдение следует проводить по крайней мере каждые три месяца, чтобы
своевременно выявить срабатывание индикаторов замены аппарата.
ПРИМЕЧАНИЕ: Поскольку срок службы таймера замены аппарата составляет три месяца (с
момента достижения статуса Explant (Деимплантация), трехмесячная частота наблюдения
является чрезвычайно важной, когда достигается статус One Year Remaining (Остался один год).
В ходе обычного наблюдения рекомендуется выполнять следующие действия:
1.
Опросите имплантированное устройство и просмотрите экран Summary (Резюме).
2.
Проверьте пороги стимуляции, импеданс электродов и амплитуду собственных импульсов
пациента.
3.
Распечатайте Quick Notes (Краткий справочник) и Patient Data (Данные пациента) и сохраните их
для использования в будущем в справочных целях.
4.
Просматривать экран Arrhythmia Logbook (Журнал регистрации аритмий), распечатывать
подробную информацию и сохраненные в памяти внутриполостные электрограммы по
заинтересовавшим вас эпизодам.
5.
Обнулите счетчики и очистите гистограммы таким образом, чтобы во время следующего
контрольного сеанса отображались только самые последние актуальные эпизодов.
6.
Убедитесь, что запрограммированные значения важных параметров (например, Lower Rate Limit
(Нижний частотный предел), AV Delay (AV-задержка), Rate Adaptive Pacing (Частотно-адаптивная
стимуляция), выходная Amplitude (Амплитуда), Pulse Width (Длительность импульса), Sensitivity
(Чувствительность) являются оптимальными для текущего состояния пациента.
ПРИМЕЧАНИЕ: Доплеровские эхо-исследования могут использоваться для неинвазивной оценки AV
Delay (АВ-задержки) и других программируемых параметров после имплантации.
100
ДЕИМПЛАНТАЦИЯ
ПРИМЕЧАНИЕ: Верните все деимплантированные имплантируемые устройства и электроды в
Boston Scientific. Исследования деимплантированных устройств и электродов могут дать
информацию для дальнейшего совершенствования надежности системы, а также позволяют
решить вопросы относительно гарантии.
ПРЕДОСТЕРЕЖЕНИЕ: Повторно не использовать, не обрабатывать и не стерилизовать. Повторное
использование, обработка или стерилизация могут нарушить целостность структуры аппарата и/или
вывести аппарат из строя, что, в свою очередь, может привести к нанесению вреда, заболеванию или
смерти пациента. Повторное использование, обработка или стерилизация могут также создать угрозу
загрязнения аппарата и/или вызвать инфекцию у пациента, или перекрестную инфекцию, в том числе
передачу инфекционного заболевания от одного пациента к другому. Загрязнение аппарата может
привести к нанесению вреда, болезни или смерти пациента.
Обращайтесь в компанию Boston Scientific в указанных ниже случаях:
•
Прекращение эксплуатации устройства.
•
Смерть пациента. В этом случае (независимо от причины) отправьте также протокол
патологоанатомического исследования, если оно проводилось.
•
По иным причинам, касающимся наблюдений или осложнений.
ПРИМЕЧАНИЕ: Утилизация деимплантированных аппаратов и/или электродов регулируется
применимыми законами и нормативами. Чтобы получить набор для возврата продукции, свяжитесь с
компанией Boston Scientific, используя информацию на задней стороне обложки.
ПРИМЕЧАНИЕ: Изменение цвета имплантируемого устройства может происходить вследствие
естественного процесса анодирования и никак не влияет на работу аппарата.
101
ПРЕДУПРЕЖДЕНИЕ: Не забудьте извлечь имплантируемое устройство перед кремацией.
Температура, при которой происходит кремирование и сжигание, может стать причиной взрыва
имплантируемого устройства.
ПРЕДУПРЕЖДЕНИЕ: Перед деимплантацией, очисткой или отправкой аппарата выполните
следующие действия, чтобы избежать перезаписи важных архивных данных по терапии:
•
Установите для параметра Brady Mode (Режим брадикардии) имплантируемого устройства
значение Off (Выкл)
•
Установите для параметра Ventricular Tachy EGM Storage (Хранение ЭГМ желудочковых
тахиаритмий) значение Off (Выкл)
Очистите и продезинфицируйте аппарат с использованием стандартных методов обращения с
биологически опасным материалом.
При деимплантации и возврате имплантируемого устройства и/или электрода следует учитывать
следующие положения:
•
Проведите опрос имплантируемого устройства и распечатайте комбинированный контрольный
отчет.
•
Отключите имплантируемое устройство перед его деимплантацией.
•
Отсоедините электроды от имплантируемого устройства.
•
Если электроды деимплантированы, старайтесь удалить их в неповрежденном виде и отправьте
обратно в компанию вне зависимости от состояния. Не используйте для извлечения электродов
кровоостанавливающие зажимы или любые другие зажимные инструменты, поскольку это может
повредить электроды. Используйте инструменты только в тех случаях, когда не удается извлечь
электроды вручную.
•
Имплантируемое устройство и электроды необходимо промыть в дезинфицирующем растворе,
чтобы удалить остатки биологических жидкостей и органических веществ, однако при этом следует
102
избегать погружения аппарата в раствор. Не допускайте попадания жидкостей в порты для
электродов имплантируемого устройства.
•
Чтобы должным образом упаковать имплантируемое устройство и/или электрод и отправить его в
компанию Boston Scientific, рекомендуется использовать набор для возврата продукции Boston
Scientific.
103