содержание .. 20 21 22 23 24 25 26 27 28 ..
4.1.8.
Массопередача с твердой фазой
В основе таких распространенных процессов пищевых производств как адсорбция, сушка, экстракция из твердых пористых материалов, лежат общие закономерности массообмена с участием твердой фазы.
Массопередача между твердой и движущейся жидкой (газовой) фазой складывается из двух процесов: 1) перемещением распределяемого компонета внутри пор твердого тела к поверхности раздела фаз (или от нее) вследствие внутренней массоотдачи, или массопроводности; 2) перенос того же вещества от поверхности раздела фаз в поток жидкости (газа, пара) за счет массоотдачи. Иными словами, массопередача является результатом внутренней и внешней диффузии.
В качестве закона, которому подчиняется кинетика переноса распределяемого вещества в твердом теле, принят закон, аналогичный закону теплопроводности: количество вещества, переместившегося в твердой фазе за счет массопроводности, пропорционально градиенту концентрации, площади, перпендикулярной направлению потока вещества, и времени, т.е.
![]() .
.
В этом уравнении коэффициент скорости процесса ![]() называется коэффициентом
массопроводности. Коэффициент массоопроводности аналогичен коэффициенту
диффузии, но при одинаковых условиях меньше его, поэтому его иногда называют
коэффициентом «стесненной диффузии».
называется коэффициентом
массопроводности. Коэффициент массоопроводности аналогичен коэффициенту
диффузии, но при одинаковых условиях меньше его, поэтому его иногда называют
коэффициентом «стесненной диффузии».
Процесс перемещения вещества внутри твердого тела может быть описан дифференциальным уравнением массопроводности:
![]()
![]() . (4.27)
. (4.27)
Вполне очевидно, что ![]() не
является постоянной величиной. Он зависит от природы процесса (адсорбция, сушка,
выщелачивание), от ряда факторов, определяющих значение коэффициента
молекулярной диффузии, и от структуры твердого пористого тела.
не
является постоянной величиной. Он зависит от природы процесса (адсорбция, сушка,
выщелачивание), от ряда факторов, определяющих значение коэффициента
молекулярной диффузии, и от структуры твердого пористого тела.
Дифференциальное уравнение массопроводности должно быть дополнено уравнением, характеризующим условия на границе раздела твердой и жидкой фаз. К элементарной площадке на границе раздела подводится вещество из твердой фазы в количестве
![]() .
.
От элементарной площадки в омывающую фазу отводится
![]() . (4.28)
. (4.28)
Приравнивая правые части этих уравнений, получим дифференциальное уравнение, характеризующие условия на границе раздела фаз:
![]() . (4.29)
. (4.29)
Из уравнения (1.29) может быть получен безразмерный комплекс делением правой на левую часть, который называется диффузионным критерием Био
![]() .
.
Критерий Био выражает отношение интенсивности переноса вещества в ядре омывающей фазы к интенсивности переноса в твердом материале, где массообмен связан с массопроводностью.
Из дифференциального уравнения массопроводности
![]()
получаем безразмерный комплекс делением правой на левую часть, который называется диффузионным критерием Фурье
![]() ,
,
характеризующим изменение скорости потока вещества, перемещаемого массопроводностью в твердом теле.
Дифференциальное уравнение массопроводности для одномерного перемещения вещества по толщине пластины (рис.4.8) имеет аналитическое решение в виде:
![]()
![]()
![]() , (4.30)
, (4.30)
где ![]() -
безразмерная концентрация распределяемого вещества в твердой фазе с координатой
-
безразмерная концентрация распределяемого вещества в твердой фазе с координатой ![]() -
текущая концентрация в точке
-
текущая концентрация в точке ![]() в
момент времени
в
момент времени ![]() -
определяющий размер твердого тела;
-
определяющий размер твердого тела; ![]() безразмерная
координата точки, в которой концентрация равна
безразмерная
координата точки, в которой концентрация равна ![]() .
.
|
|
В рассматриваемом случае в момент времени ![]() концентрация
внутри пластины меняется от
концентрация
внутри пластины меняется от ![]() ,
в зависимости от координаты
,
в зависимости от координаты ![]() ,
т.е.
,
т.е. ![]() .
.
Рис.4.8. Осесимметричное изменение концентрации распределяемого компонента по толщине пористой твердой пластины во времени.
4.2. Абсорбция
Абсорбцией называется процесс разделения, основанный на избирательном поглощении газов или паров жидкими поглотителями – адсорбентами.
При физической абсорбции поглощаемый газ (абсорбтив) не взаимодействует химически с абсорбентом. Если же абсорбтив образует с абсорбентом химическое соединение, то процесс называется хемосорбцией.
Физическая абсорбция обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора – десорбция.
Сочетание абсорбции и десорбции позволяет многократно применять поглотитель (абсорбент) и выделять поглощенный компонент в чистом виде.
4.2.1. Равновесие при абсорбции
При абсорбции содержание газа в растворе зависит от свойств газа и жидкости, давления, температуры и состава газовой смеси.
В случае растворения в жидкости бинарной газовой
смеси взаимодействуют две фазы (Ф=2), число компонентов равно трем (![]() =3)
и, согласно правилу фаз Гиббса
=3)
и, согласно правилу фаз Гиббса
![]() ,
,
число степеней свободы системы равно трем (С=3). Т.е. для данной системы газ-жидкость переменными являются температура, давление и концентрации в обеих фазах. Следовательно, в состоянии равновесия при постоянном давлении и температуре зависимость между концентрациями газа и жидкости однозначна. Эта зависимость выражается законом Генри: при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
![]() , (4.31)
, (4.31)
где Е – коэффициент пропорциональности, называемый константой Генри.
Коэффициент Е зависит от природы растворяющегося вещества и температуры:
![]() , (4.32)
, (4.32)
где ![]() -
дифференциальная теплота растворения газа;
-
дифференциальная теплота растворения газа; ![]() -
постоянная, зависящая от природы газа и растворителя, определяемая опытным
путем.
-
постоянная, зависящая от природы газа и растворителя, определяемая опытным
путем.
Из равенств (4.31) и (4.32) следует, что с ростом температуры растворимость газов в жидкостях уменьшается.
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона, парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси
![]() .
.
Сопоставляя последнее равенство с (2.1), получим
![]() (4.33)
(4.33)
В общем случае константа фазового равновесия ![]() зависит
от общего давления
зависит
от общего давления ![]() ,
температуры и концентрации распределяемого компонента в жидкости
,
температуры и концентрации распределяемого компонента в жидкости ![]() .
Эта функция для некоторых систем может быть вычислена, но в большинстве случаев
ее находят опытным путем.
.
Эта функция для некоторых систем может быть вычислена, но в большинстве случаев
ее находят опытным путем.
Уравнение (4.33) выражает зависимость между равновесными концентрациями распределяемого газа в газовой и жидкой фазах. Анализ и расчет процесса абсорбции удобнее всего проводить, выражая концентрации распределяемого компонента в относительных единицах, т.к. в этом случае расчетные значения потоков газовой и жидкой фаз постоянны.
Уравнение равновесия, выраженное через относительные мольные доли
![]() ;
; ![]() ;
; ![]() ,
,
можно переписать следующим образом
![]() .
.
При незначительных концентрациях ![]() <<1,
и уравнение приобретает более простой вид:
<<1,
и уравнение приобретает более простой вид:
![]() .
.
К факторам, улучшающим растворимость газов в жидкостях, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, - пониженное давление, повышенная температура и прибавление к абсорбенту добавок, уменьшающих растворимость газов в жидкостях.
Закон Генри справедлив для смесей газов,
критические температуры которых выше температуры раствора, и справедлив только
для идеальных растворов, т.е. соблюдается при малых концентрациях растворенного
газа или при его малой растворимости. Для хорошо растворимых газов, при больших
концентрациях их в растворе, растворимость меньше, чем следует из закона Генри.
Для систем, не подчиняющихся закону, коэффициент ![]() в
уравнении равновесия является величиной переменной, и линия равновесия
представляет собой кривую, которую строят обычно по опытным данным.
в
уравнении равновесия является величиной переменной, и линия равновесия
представляет собой кривую, которую строят обычно по опытным данным.
При повышенных давлениях (десятки атмосфер и выше) равновесие не следует закону Генри, т.к. изменение объема жидкости вследствие растворения в ней газа становится соизмеримым с изменением объема газа. При этих условиях константа фазового равновесия определяется следующим образом:
![]() ,
,
где ![]() -
фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
-
фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
Для бинарных растворов фугитивность ![]() может
быть определена по уравнению
может
быть определена по уравнению
![]() ,
,
где А – постоянная, значение которой можно найти в справочной литературе.
В случае абсорбции многокомпонентных смесей равновесные зависимости значительно сложнее, чем при абсорбции одного компонента, особенно в тех случаях, когда раствор значительно отличается от идеального. При этом парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но также и от концентрации в растворе остальных компонентов, т.е. является функцией большого числа переменных.
4.2.2. Материальный, тепловой балансы и кинетические закономерности абсорбции
Материальный баланс процесса выражается общим уравнением
![]() ,
,
отсюда общий расход абсорбента
![]() ,
,
а его удельный расход
![]() . (4.34)
. (4.34)
Это уравнение можно переписать следующим образом:
![]() . (4.35)
. (4.35)
Уравнение (4.35) показывает, что изменение
концентрации в абсорбционном аппарате происходит прямолинейно и, следовательно,
в координатах ![]() рабочая
линия процесса абсорбции представляет собой прямую линию с углом наклона,
тангенс которого равен
рабочая
линия процесса абсорбции представляет собой прямую линию с углом наклона,
тангенс которого равен ![]() .
.
Между удельным расходом абсорбента и размерами
аппарата существует определенная связь. Через точку с координатами ![]() (рис.
4.9) проведем в соответствие с уравнением (4.35) рабочие линии ВА, ВА1, ВА2, ВА3,
отвечающие разным удельным расходам абсорбента. При этом точки А, А1, А2, А3 будут
лежать на одной горизонтальной прямой, соответствующей заданной начальной
концентрации газа в смеси
(рис.
4.9) проведем в соответствие с уравнением (4.35) рабочие линии ВА, ВА1, ВА2, ВА3,
отвечающие разным удельным расходам абсорбента. При этом точки А, А1, А2, А3 будут
лежать на одной горизонтальной прямой, соответствующей заданной начальной
концентрации газа в смеси ![]() .
.
Рабочая линия ВА, совпадающая с
вертикалью, соответствует максимальной движущей силе процесса, однако удельный
расход абсорбента в этом случая будет бесконечно большим (![]() ).
Если же рабочая линия ВА3 касается линии равновесия, то
удельный расход абсорбента - минимален (
).
Если же рабочая линия ВА3 касается линии равновесия, то
удельный расход абсорбента - минимален (![]() .
Движущая сила в точке касания рабочей равновесной линий равна нулю, в ней
рабочая концентрация становится равной равновесной. При бесконечно большом
расходе адсорбента размеры аппарата будут наименьшими, при минимальном расходе –
бесконечно большими. Следует отметить, что оба случая являются предельными и
практически неосуществимыми.
.
Движущая сила в точке касания рабочей равновесной линий равна нулю, в ней
рабочая концентрация становится равной равновесной. При бесконечно большом
расходе адсорбента размеры аппарата будут наименьшими, при минимальном расходе –
бесконечно большими. Следует отметить, что оба случая являются предельными и
практически неосуществимыми.
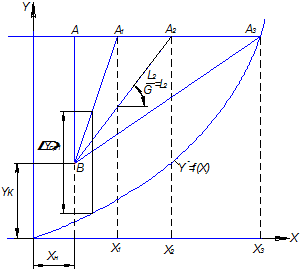
Рис.4.9. К определению удельного расхода абсорбента.
В реальном абсорбере равновесие между фазами не
достигается и всегда ![]() ,
где
,
где ![]() -
концентрация поглощаемого газа в жидкости, находящейся в равновесии с
поступающим газом. Отсюда следует, что величина
-
концентрация поглощаемого газа в жидкости, находящейся в равновесии с
поступающим газом. Отсюда следует, что величина ![]() всегда
быть больше минимального значения
всегда
быть больше минимального значения ![]() ,
отвечающего предельному положению рабочей линии (ВА3).
Значения удельного минимального расхода абсорбента можно определить по формуле:
,
отвечающего предельному положению рабочей линии (ВА3).
Значения удельного минимального расхода абсорбента можно определить по формуле:
![]() (4.36)
(4.36)
Значение ![]() является
отправной величиной для установления действительного расхода абсорбента при
расчете и проектировании абсорберов. Действительный расход абсорбента должен
быть больше минимального и равен оптимальному его значению, которое можно
установить в результате технико-экономического расчета. В предварительных
расчетах можно принимать
является
отправной величиной для установления действительного расхода абсорбента при
расчете и проектировании абсорберов. Действительный расход абсорбента должен
быть больше минимального и равен оптимальному его значению, которое можно
установить в результате технико-экономического расчета. В предварительных
расчетах можно принимать
![]() .
.
При растворении газа в жидкости температура жидкости обычно повышается вследствие выделения тепла. Если абсорбция ведется без отвода тепла, то можно допустить, что все выделяющееся тепло идет на нагревание жидкости.
Количество тепла, выделяющегося при абсорбции для определенного сечения аппарата, может быть найдено по уравнению
![]() .
.
Температура абсорбента при подводе тепла повышается на величину
![]() ,
,
где q – дифференциальная теплота растворения газа; с – теплоемкость раствора.
Тогда изменение температуры абсорбента по длине (высоте) абсорбера может быть вычислено по зависимости:
![]() .
.
Задаваясь рядом произвольных значений ![]() в
интервале между известными концентрациями
в
интервале между известными концентрациями ![]() ,
по вышеприведенной зависимости вычисляют температуру абсорбента. По опытным
данным определяются соответствующие значения равновесных концентраций
,
по вышеприведенной зависимости вычисляют температуру абсорбента. По опытным
данным определяются соответствующие значения равновесных концентраций ![]() и
строят линию равновесия (по точкам О1 , О2 и т.д , рис.
4.10.).
и
строят линию равновесия (по точкам О1 , О2 и т.д , рис.
4.10.).
Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для двухфазных систем:
![]() .
.
В этих уравнениях движущую силу ![]() часто
заменяют разностью парциальных давлений распределяемого компонента
часто
заменяют разностью парциальных давлений распределяемого компонента ![]() ,
а
,
а ![]() .
Тогда
.
Тогда
![]() .
.
При таком способе выражения концентрации уравнение для равновесной зависимости имеет вид
![]() .
.

Рис.4.10. Кривая равновесия при неизотермической абсорбции.
Соответственно коэффициенты массопередачи выражаются в виде:
![]() ; (4.37)
; (4.37)
![]() . (4.38)
. (4.38)
Чем выше растворимость газа, тем больше значение
величины ![]() .
Для плохо растворимых газов
.
Для плохо растворимых газов ![]() имеет
наименьшее значение. Величина
имеет
наименьшее значение. Величина ![]() влияет
на структуру уравнений, описывающих коэффициент массопередачи. Если
влияет
на структуру уравнений, описывающих коэффициент массопередачи. Если ![]() велико,
то в уравнении (4.37) величина
велико,
то в уравнении (4.37) величина ![]() .
Тогда можно считать
.
Тогда можно считать ![]() ,
т.е. в данном случае диффузионное сопротивление сосредоточено в газовой фазе.
Если
,
т.е. в данном случае диффузионное сопротивление сосредоточено в газовой фазе.
Если ![]() мало,
то в уравнении (4.38)
мало,
то в уравнении (4.38) ![]() ,
и можно полагать
,
и можно полагать ![]() ,
т.е. в этом случае сопротивление сосредоточено в жидкой фазе.
,
т.е. в этом случае сопротивление сосредоточено в жидкой фазе.
Коэффициенты массопередачи по жидкой и газовой фазам рассчитываются по критериальным уравнениям, полученным на основании теории подобия. Такие уравнения обычно представляются в виде:
![]() .
.
Постоянные коэффициенты ![]() устанавливаются
при обработке экспериментальных данных.
устанавливаются
при обработке экспериментальных данных.
При расчете абсорбции для случая, когда жидкость стекает по стенке тонкой пленкой, а газ соприкасается с абсорбентом по поверхности этой пленки, коэффициент массоотдачи для газовой фазы может быть рассчитан по формуле:
![]() ,
,
где ![]() ;
; ![]() .
.
Зависимость справедлива для ![]() 100-10000
и
100-10000
и ![]() 0,5
– 2,0.
0,5
– 2,0.
Для жидкой пленки в насадочных колоннах критериальная зависимость имеет вид
![]() .
.
4.2.3. Cхемы абсорбционных процессов
В пищевых производствах нашли следующие схемы абсорбционных процессов: прямоточные, противоточные, одноступенчатые с рециркуляцией и многоступенчатые с рециркуляцией.
Прямоточная и противоточная схемы взаимодействия фаз в процессе приведены на рис.4.11.
В прямоточной схеме потоки газа и жидкости движутся параллельно друг другу. Газ с большей концентрацией распределяемого вещества контактирует с жидкостью, имеющей меньшую концентрацию распределяемого компонента, а газ с меньшей концентрацией взаимодействует на выходе аппарата с жидкостью, имеющей большую концентрацию распределяемого вещества.
В противоточной схеме в одном конце аппарата приводятся в контакт газ и жидкость, имеющие большие концентрации распределяемого вещества, а в противоположном конце – меньшие.
Схемы с рециркуляцией предусматривают многократный возврат в аппарат либо жидкости, либо газа. Схемы с рециркуляцией жидкости и газа приведены на рис. 4.12.
Газ проходит через аппарат снизу вверх.
Концентрация распределяемого вещества в нем изменяется от ![]() .
Абсорбент подводится к верхней части аппарата с концентрацией распределяемого
вещества
.
Абсорбент подводится к верхней части аппарата с концентрацией распределяемого
вещества ![]() и
затем смешивается с выходящей из аппарата жидкостью. В результате смешения
концентрация адсорбента повышается до
и
затем смешивается с выходящей из аппарата жидкостью. В результате смешения
концентрация адсорбента повышается до ![]() .
Значение концентрации
.
Значение концентрации ![]() можно
вычислить из уравнения материального баланса.
можно
вычислить из уравнения материального баланса.
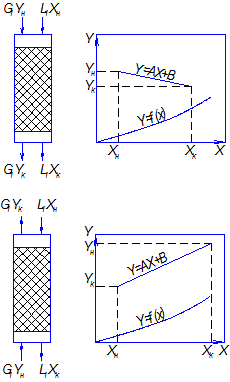
Рис.4.11. Прямоточная и противоточная схемы абсорбции.
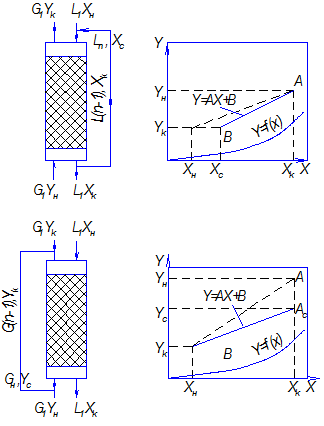
Рис. 4.12. Противоточные схемы абсорбции с рециркуляцией жидкости и газа.
Введя обозначение кратности рециркуляции ![]() ,
представляющей собой отношение количества абсорбента на входе в аппарат к
количеству свежей жидкости, получим:
,
представляющей собой отношение количества абсорбента на входе в аппарат к
количеству свежей жидкости, получим:
![]() ;
;
![]() .
.
Кратность рециркуляции по газу ![]() .
Ордината
.
Ордината ![]() в
этом случае определяется из материального баланса:
в
этом случае определяется из материального баланса:
![]() ;
;
![]() .
.
Одноступенчатые схемы с рециркуляцией выполняются противоточными и прямоточными.
Многоступенчатые схемы с рециркуляцией могут включать прямой ток, противоток, рециркуляцию жидкости и рециркуляцию газа. Большое практическое значение имеет многоступенчатая противоточная схема с рециркуляцией жидкости в каждой ступени (рис.4.13.).
Рабочие линии наносят на диаграмму отдельно для каждой ступени, как и в случае нескольких одноступенчатых аппаратов.
Применение схем с рециркуляцией абсорбента целесообразно в следующих случаях: когда сопротивление массопередаче сосредоточено в жидкой фазе; при необходимости охлаждать абсорбент в процессе абсорбции; для улучшения смачивания насадки (при малых плотностях орошения). Однако рециркуляция жидкости ведет к усложнению абсорбционных установок и дополнительным расходам энергии на перекачивание рециркулирующей жидкости.
Схемы установок, приведенные на рис. 4.11.-4.13., относятся к насадочным абсорберам, в которых затруднительна организация внутреннего отвода тепла в процессе абсорбции. В тарельчатых абсорберах охлаждающие устройства (например, змеевики) устанавливают на тарелках.
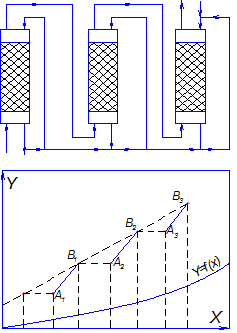
Рис.4.13. Многоступенчатая противоточная схема абсорбции
с рециркуляцией жидкости.
содержание .. 20 21 22 23 24 25 26 27 28 ..
